
题目列表(包括答案和解析)
4.下列说法中正确的是
A.最外层有2个电子的原子(除氦外)都是金属原子
B.原子最外层电子数相同的不同元素,其单质的化学性质一定相似
C.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
D.溴元素位于周期表的第7纵行
3.下列有关物质的结构或性质的叙述错误的是
A.H3BO3、H2CO3、HNO3的酸性逐渐增加
B.BeSO4、MgSO4、CaSO4、BaSO4的溶解性逐渐减弱
C.S2-、Cl-、K+、Ca2+的离子半径依次增大
D.NH3、PH3的水溶性依次降低
2.A、B、C、D、E均为短周期元素。A、B、C位于同一周期相邻位置,它们分别与D形成的分子中都有10个电子,且A和C的原子序数之比为3:4。E原子从内到外各电子层的电子数之比为1:4:1。则下列叙述正确的是
A.由A和C形成的一种化合物能与E的单质在一定条件下发生置换反应
B.由A,C原子和B、D原子分别构成的分子电子数相等
C.B、D两种单质相互化合的反应是不可逆反应
D.由A、B、C、D四种元素形成的化合物一定不属于无机盐
1.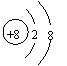 下列各项表达式正确的是
下列各项表达式正确的是
A.O2―的结构示意图:
B.Na2S的电子式: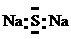
C.甲醛的结构简式:CH2O
D.氮分子的结构式: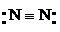
14.(10分)如右下图所示两个等体积的容器,A为恒压容器,B为恒容容器。在相同温度下,分别将1 mol N2 和3 mol H2 混合气体充入A、B容器中,发生如下反应:
 N2(g)+3 H2 (g) 2NH3
(g); △H=-92.4 kJ/mol 。
N2(g)+3 H2 (g) 2NH3
(g); △H=-92.4 kJ/mol 。
保持温度不变,A、B容器中的反应均达到平衡状态。平衡时,A容器中气体体积为起始时的4/5,平衡状态记为P。
试回答下列问题:
(1) 平衡时A容器中NH3 的体积分数是 。若要使B容器中NH3 的体积分数与 A容器中相同,可采取的措施是 。
(2) 若保持温度不变,向B容器中补加c mol NH3 ,再次达到平衡时,A、B两容器中压强恰好相等,则c= 。
(3)若保持温度不变,开始时向容器A中加入a mol N2 、b mol H2和c mol NH3 ,要使反应向逆反应方向进行,且达到平衡后各气体的物质的量与原A平衡状态P相同,则起始时,c的取值范围是 。
(4)若保持温度不变,开始时向容器B中加入a mol N2 、b mol H2 和 1 mol NH3 ,平衡时,测得放出的热量为23.1 kJ,NH3 的体积分数与A容器平衡状态P相同,则a + b 的值是 。
13.(10分)373K时,某1L密闭容器中发生如下可逆反应:A(g)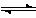 2B(g)。其中物质B的物质的量变化如图所示:
2B(g)。其中物质B的物质的量变化如图所示:
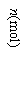
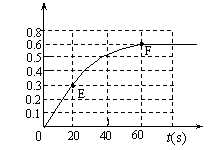
试填空:
⑴已知373K时60s达到平衡,则前60s内A的平均反应速率为 。
⑵若373K时B的平衡浓度为是A的3倍,473K时(其他条件不变),B的平衡浓度为A的2倍,请在上图中画出473K时A的物质的量随时间的变化曲线。
⑶若反应在373K进行,在1L密闭容器中加入1mol B、0.2molHe,达到平衡时B的转化率应 。
A.等于60% B.等于40% C.小于40% D.介于40%-60%之间
⑷已知曲线上任意两点之间连线的斜率表示该时段内B的平均反应速率(例如直线EF的斜率表示20s~60s内B的平均反应速率),试猜想曲线上任意一点的切线斜率的意义 。
12.(10分)合成氨工业对化学工业和国防工业具有重要意义,对我国实现农业现代化起着重要作用。根据已学知识回答下列问题:
 已知N2 (g) + 3H2 (g) 2NH3(g) △H =-92.4kJ·mol-1
已知N2 (g) + 3H2 (g) 2NH3(g) △H =-92.4kJ·mol-1
(1)合成氨工业采取的下列措施不可用平衡移动原理解释的是 (填序号);
A.采用较高压强(20MPa ~50MPa) B.采用500℃的高温
C.用铁触媒作催化剂 D.将生成的氨液化并及时从体系中分离出来
(2)合成氨工业中采用了较高压强(20MPa ~50MPa),而没有采用100MPa或者更大压强,试解释没有这么做的理由 ;
(3)在容积均为2L(容器体积不可变)的甲、乙两个容器中,分别加入2molN2、6molH2和1molN2、3molH2,在相同温度、催化剂下使其反应。最终达到平衡后,两容器N2转化率分别为α甲、α乙,则甲容器中平衡常数表达式为 (用含α甲的代数式表示),此时α甲 α乙(填“>”、“<”“=”)。
11.(10分)在一定温度下有甲、乙两容积相等的容器。
(1)向甲容器中通入3 mol N2和4 mol H2,反应达到平衡时,生成NH3 a mol。此时,NH3的物质的量分数是 。若在达到平衡状态的甲容器中通入少量的N2,则达到新平衡时,体系中N2的体积分数将 (选填“增大”、“减小”若“不变”)。
(2)向乙中通入2 mol NH3,欲使反应达到平衡时,各物质的浓度与(1)中第一次平衡时相同,则起始时还需通入 molN2和 molH2。
(3)若起始时,向乙中通入6molN2和8molH2,达到平衡时,生成的NH3的物质的量为b mol,则
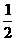 (选填“>”、“<”或“=”)。
(选填“>”、“<”或“=”)。
10. 一定温度下,有可逆反应:2A(g)+2B(g) C(g)+3D(g);△H<0。现将2mol A和2molB充入体积为V的甲容器,将2 molC和6mol D充入体积为2V的乙容器。关于两容器中反应的说法正确的是
一定温度下,有可逆反应:2A(g)+2B(g) C(g)+3D(g);△H<0。现将2mol A和2molB充入体积为V的甲容器,将2 molC和6mol D充入体积为2V的乙容器。关于两容器中反应的说法正确的是
A.甲容器中的反应先达到化学平衡状态
B.两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成相同,混合气体
的平均相对分子质量也相同
C.两容器达平衡后升高相同的温度,达到新的平衡,甲乙容器中平衡混合物中各组份
的体积百分组成不同
D.在甲容器中再充入2 mol A和2 mol B,平衡后甲中物质C的浓度是乙中物质C的浓
度的2倍
9. 随着信息技术的迅猛发展,计算机在化学化工领域得到了广泛应用。下面四幅图是用计算机制作的在密闭容器里,在不同条件下进行反应:X(g) Y(g)达到平衡的图解。图中的“●”是X,“○”是Y。
随着信息技术的迅猛发展,计算机在化学化工领域得到了广泛应用。下面四幅图是用计算机制作的在密闭容器里,在不同条件下进行反应:X(g) Y(g)达到平衡的图解。图中的“●”是X,“○”是Y。
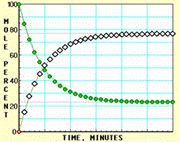
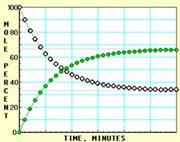
图Ⅰ 图Ⅱ
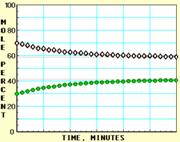
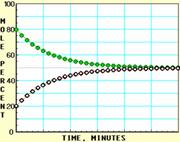
图Ⅲ 图Ⅳ
下列有关说法正确的是
A.图中的纵坐标表示物质的物质的量分数
B.四幅图中,图Ⅲ所示反应达到平衡时,X的转化率为37.5%
C.图Ⅰ和图Ⅱ所采用的不同条件是反应体系压强不同
D.图Ⅳ说明反应开始时是向正反应方向进行的
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com