
题目列表(包括答案和解析)
11.常温下,浓度为0.1 mol/L的一元酸HA溶液的pH=2.0,浓度为0.1 mol/L的一元碱BOH溶液中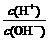 =1.0×10-12。将此两种溶液等体积混合后,所得溶液中离子浓度大小关系正确的是
=1.0×10-12。将此两种溶液等体积混合后,所得溶液中离子浓度大小关系正确的是
A.c(OH-)>c(H+)>c(B+)>c(A-) B.c(B+)>c(A-)>c(H+)>c(OH-)
C.c(B+)>c(A-)>c(OH-)>c(H+) D.c(A-)>c(B+)>c(H+)>c(OH-)
10. 设NA表示阿伏加德罗常数,下列有关说法正确的是
A.1 mol HNO3见光分解,转移电子数4NA
B. 28 g乙烯与28 g丙烯中均含有6NA对共用电子对
C.合成氨反应中,当断裂 3NA个H-H键的同时生成 6NA个N-H键,则该反应达到平衡状态
D.7.8 g Na2O2含有的阴离子数目为0.2 NA
9.下列离子方程式书写正确的是
A.Na2CO3饱和溶液中通入足量CO2:CO32-+CO2+H2O=2HCO3-
B.NaxB溶液水解:Bx-+xH2O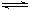 HxB +xOH-
HxB +xOH-
C.浓氢氧化钠溶液吸收少量SO2气体:SO2+2OH-=SO32-+H2O
D.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
8.联合制碱法中关键的一步是把NH4Cl从几乎饱和的NaHCO3溶液中分离出来,为此根据NaCl和NH4Cl溶解度的差异,向混合溶液中通入某种气体,同时加入磨细的食盐,可析出不夹带NaHCO3的NH4Cl。NaCl和NH4Cl共同存在时的溶解度曲线如图所示,以下操作正确的是
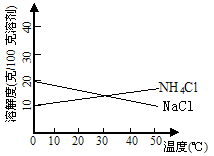
|
|
通入气体 |
温度控制 |
|
(A) (B) (C) (D) |
CO2 CO2 NH3 NH3 |
30-40℃ 0-10 ℃ 30-40 ℃ 0-10℃ |
7.化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。现提供以下化学键的键能(KJ·mol-1)Si-O:460、Si-Si:175、O=O:498,则反应:Si + O2 = SiO2的反应热△H为
A.-992 KJ·mol-1 B.-247 KJ·mol-1
C.-236 KJ·mol-1 D.+236 KJ·mol-1
6.从矿物学资料查得,一定条件下自然界存在如下反应:
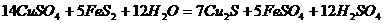 ,下列说法正确的是
,下列说法正确的是
A. Cu2S既是氧化产物又是还原产物
B. 5mol FeS2发生反应,有10mol电子转移
C. 产物中的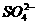 离子有一部分是氧化产物
离子有一部分是氧化产物
D. FeS2只作还原剂
5.在一定体积某浓度的BaCl2溶液中,逐滴加入pH=1的稀硫酸至溶液中的Ba2+恰好完全沉淀时,测得溶液pH=2,若忽略两溶液混合时的体积变化,则稀硫酸的体积与BaCl2溶液的体积比是
A.10:1 B.1:10 C.9:1 D.1:9
4.关于晶体的下列说法正确的是
A.在晶体中只要有阴离子就一定有阳离子
B.在晶体中只要有阳离子就一定有阴离子
C.离子晶体中,只存在离子键
D.分子晶体中一定存在共价键
3.在高能加速器中,将7030Zn撞入一个20882Pb的原子核并释放出一个中子后,合成一种人造重元素的原子。该元素原子核内中子数为
A.165 B.166 C.277 D.278
2.纳米技术广泛应用于催化及军事科学中,纳米材料是指粒子直径在几纳米到几十纳米的材料。如将纳米材料分散到液体分散剂中,所得混合物可能具有的性质是(1纳米=10-9米)
A.能全部透过半透膜; B.有丁达尔现象;
C.所得溶液一定能导电; D.所得物质一定为悬浊液或乳浊液。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com