
题目列表(包括答案和解析)
8.下列混合物在物质的量一定时,组内各物质按任意比例混合,完全燃烧时消耗O2的量不变的是( )
A.甲烷、乙烯、甲醇 B. 乙烯、乙醇、羟基丙酸
C.乙炔、苯、苯乙烯 D. 丙烯、2-丁烯、丁醛
7.下列判断正确的是( )
A.任何液溶胶加入可溶性电解质后都能使胶体粒子凝成较大颗粒形成沉淀析出
B.丁达尔现象、布朗运动、电泳现、胶体凝聚中都只涉及到分散系的物理性质
C.因为胶体粒子比溶液中溶质粒子大,所以胶体可以用过滤的方法把胶粒分离出来
D.胶体与其它分散系的本质区别是分散质粒子直径在1nm--100nm之间
6.下列说法不正确的是( )
①一种元素只有一种原子,但可能有多种离子;②阴离子或阳离子有可能既有氧化性也有还原性;③由同种元素组成的物质属于单质;④有新单质生成的化学反应不一定是氧化还原反应;⑤具有相同质子数的粒子都属于同种元素。
A.①③⑤ B.①②③ C.③④⑤ D.①③④
22. 实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分及物质的量浓度,进行以下实验:
取25mL甲溶液,向其中缓慢滴入乙溶液15mL,共收集到224mL(标准状况)气体。
取15mL乙溶液,向其中缓慢滴入甲溶液25mL,共收集到112mL(标准状况)气体。
(1)判断:甲是 溶液;
(2)求甲、乙两溶液的物质的量浓度各为多少?
21. 实验室有一瓶Na2SO3固体,可能含有NaCl、Na2SO4、KNO3、K2CO3、K2SO4中的一种或几种杂质,通过下列实验确定该样品的成分及Na2SO3质量分数。
称此样品6.30g,加入6.0mol/L的硫酸至过量,产生无色气体560mL(标准状况),向逸出气体后的溶液中加入稍过量的BaCl2溶液,得到白色沉淀9.32g,透过蓝色钴玻璃观察,滤液的焰色反应无紫色。请根据实验填写下列空白:
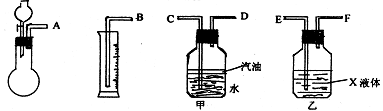
① 若用下图所示仪器组装进行上述实验,气流从左到右各仪器的正确连接顺序为(填编号字母)_______接 , 接 , 接 ,液体X是 ,汽油的作用是 。
② 操作时,怎样才能正确地测出放出气体的体积 。
③ 若实验中加入硫酸溶液的体积为5.00mL,则样品中Na2SO3的质量分数是 。
一定含有的杂质是____________。
20. A、B、C、D、E是五种中学化学常见的单质,已知A、B、C、D在常温下均为气态,E为金属。其中D能分别跟A、B、C在一定条件下化合,生成对应的化合物为X、Y、Z,其中常温下,Y为液体,X、Z为气体。有关的转化关系如下图所示(反应条件均已略去)。
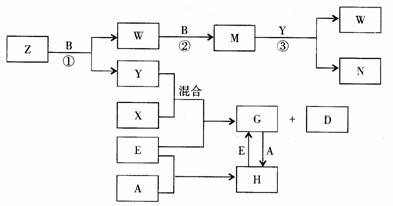
回答下列问题:
(1)A的化学式为_______________;
(2)写出反应③的化学反应方程式_________________________;
(3)Z和W在催化剂作用下反应生成C和Y,这是一个很有实际意义的反应,可以消除W对环境的污染,该反应的化学方程式为___________________;
(4)将过量的E加到N的稀溶液中,若过程中转移电子的数目为3.01×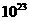 ,则参加反应的E的质量为________g;
,则参加反应的E的质量为________g;
(5)将Z与N反应后的产物溶于水中,则常温该溶液的pH_____7,其原因是(用离子方程式表示)_______________________。
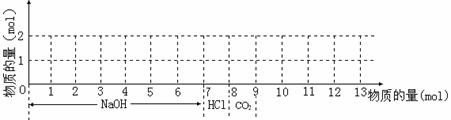
19. 若含有1molMg2+和1molAl3+的混合溶液,现按下图横坐标依次加入NaOH溶液、盐酸,通入CO2气体,纵坐标为混合沉淀的物质的量。请画出沉淀的量随反应的变化曲线,并写出各步反应的离子方程式。
18. 常温下,某混合气体可能由He、N2、O2、NH3、H2、NO、HCl和CO2气体中的两种或几种混合而成。取200mL该混合气体进行如下实验:① 将混合气体通过浓硫酸,体积减少40mL;② 将剩下的气体通过盛有Na2O2的容器,反应完毕后,体积减少40mL;③将剩余气体引燃后,再冷却至室温,气体体积减少105 mL,最后剩余气体15 mL,其中5 mL是O2;整个反应过程中,气体颜色均没有变化,问:
(1)原混合气体中一定有____________,混合前各有多少毫升____________。
(2)原混合气体中一定没有____________。
(3)原混合气体中可能有____________,混合前共多少毫升____________。
17. BGO是我国研制的一种闪烁晶体材料,曾用于诺尔奖获得者丁肇中的著名实验,它是锗酸铋的简称。若知:① 在BGO中,锗处于其最高价态,② 在BGO中,铋的价态与铋跟氯形成某种共价氯化物时所呈的价态相同,在此氯化物中铋具有最外层8电子稳定结构,③ BGO可看成是由锗与铋两种元素的氧化物所形成的复杂氧化物,且在BGO晶体的化学式中,这两种氧化物所含氧的总质量相同。请填空:
(1)锗和铋的元素符号分别是 和 。
(2)BGO晶体的化学式是 。
(3)BGO晶体中所含铋氧化物的化学式是 。
16. 等质量的钠、钾、锌分别投入到含等量氯化氢的稀盐酸中充分反应,产生氢气的量的多少不会出现下列情况中的( )
A. Zn>Na>K B. Na>Zn>K
C. Na>K>Zn D. Na>K=Zn
第Ⅱ卷
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com