
题目列表(包括答案和解析)
题意。 若正确答案只包括一个选项,多选时,该题为0 分;若正确答案包拾两个选项,只选1 个且正确的给2 分,选两个且都正确的给满分,但只要选错一个该小题就为0 分)
9. 合成氨工业对国民经济和社会发展具有重要的意义。哈伯法合成氨需要在20~50MPa的
高压和500℃左右的高温下,并用铁触媒作为催化剂,氨在平衡混合物中的含量仍较少。
最近英国俄勒冈大学的化学家使用了一种名为 trans一Fe(DMeOPrPE)2 的新催化剂,
在常温下合成氨,反应方程式可表示为N2 +3H2 2NH3
. 有关说法正确的是
2NH3
. 有关说法正确的是
A.哈伯法合成氨是吸热反应,新法合成氨是放热反应
B.新法合成氨不需要在高温条件下,可节约大量能源,具有发展前景
C. 新法合成氨能在常温下进行是因为不需要断裂化学键
D. 新催化剂降低了反应所需要的能量,提高了活化分子百分数
29、(15分)某同学设计了如右图装置,以便于准确观察铜片与稀硝酸反应的现象。c为止水夹,a、b为耐酸的多孔胶塞片(厚度1--2mm,高度可以调整),实验过程中可以选用的试剂:铜片、稀硝酸、块状CaCO3.回答下列问题:
(1)写出Cu与稀HNO3反应的离子方程式 。
 (2)适量的大理石放在
片上(填“a” 或“b”,下同),其作用是 。
(2)适量的大理石放在
片上(填“a” 或“b”,下同),其作用是 。
(3)欲使反应现象更为明显,则加入的铜片为 。
a.粗铜片 b。纯铜片
(4)实验操作步骤:①装好药品,打开止水夹c;②升高漏斗位置,让a片上的物质与稀硝酸接触;③充分反应后,再向漏斗中加入足量的稀硝酸至淹没b片上物质,并立即关闭止水夹c。
立即关闭止水夹c的原因是:① , ② 。
(5)实验中,可以观察到铜片与稀硝酸反应的现象为:
① ,② ,
③ ,④ 。
28、(14分)现有分子式为C9H9O2X的物质甲(X为卤族元素),在一定条件下有如下的转化关系,其中E可作为工业上的增塑剂。

(1)写出下列物质的结构简式:甲 A 。
(2)上述反应中,属于氧化反应的有(填序号,下同) ,属于取代反应的有 。
(3)写出D的同分异构体的结构简式,该同分异构体苯环上的一氯代物有2种
(4)写出下列反应的化学方程式:
B→C ,
F→G 。
27. (14分)A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:
(14分)A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:
(1)常温下,若A为气态单质,C为非金属氧化物,A、C均能使品红溶液褪色,相对分子质量E﹥D,则:
该反应的反应方程式为 ,
检验D中阴离子的方法是 。
(2)若A为短周期的金属单质,D为气态单质,C溶液呈强酸性或强碱性时,该反应都能进行。写出反应的离子方程式 ;
。
(3)若A、C均为化合物,E为白色沉淀,C为引起温室效应的主要气体,写出E可能的化学式(写两种) 、 。
写出生成E的一个离子方程式 。
26.(17分)下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
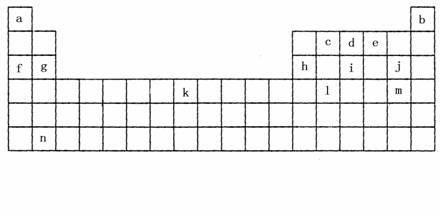
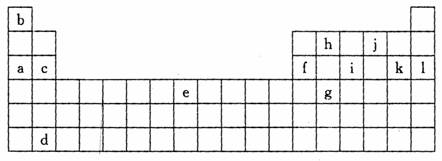
(1)上表所列元素中,原子最外层只有2个电子的短周期元素是(填元素符号) ;元素i的最高氧化物的化学式为 ,元素i最高氧化物的水化物的化学式为 。
(2)k位于元素周期表中第 族,写出该元素的单质在高温下与水蒸气反应的化学方程式 。
(3)已知与f在同一周期的元素R位于第p主族,则R的原子序数为(用p的代数式表示) ,R能形成气态氢化物,其氢化物的化学式为 。
(4)W、X、Y、Z为表中所列的四种元素,其原子序数X﹥W﹥Z﹥Y,X原子最外层电子数是其内层电子之和的1/5,Y原子最外层电子数是次外层电子数的2倍,W原子和Z原子可形成或2 : 1和1 : 1两种离子化合物。
①四种元素原子的半径由大到小的顺序为(填元素符号)
②写出两个由Y Z2参加的氧化还原反应方程式,其它反应物由上面四种元素的一种或几种组成
。
13.有硫酸镁溶液500mL,它的密度是1.20g/cm3,其中镁离子的质量分数是4.8%,则有关该溶液的说法正确的是( )
A.溶质的质量分数是24.0%
B.溶液的物质的量浓度是2.4mol/L
C.溶质和溶剂的物质的量比是1:40
D.硫酸根离子的质量分数是19.2%
12.无色溶液可能由K2CO3、MgCl2、NaHCO3、BaCl2溶液中的一种或几种组成。向
溶液中加入烧碱溶液出现白色沉淀,加入稀硫酸也出现白色沉淀并放出气体。据此分析,下列判断中正确的是( )
①肯定有BaCl2;②肯定有MgCl2;③肯定有NaHCO3;④肯定有Na2CO3或NaHCO3⑤肯定没有MgCl2
A.①②③ B.②④ C.①③ D.①③⑤
11.以氢氧化钾溶液、氢气、氧气组成的燃料电池,电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法不正确的是( )
A.当电池负极消耗mg气体时,电解池阴极有mg气体生成
B.电解池的阳极反应式为:4OH-- 4e-==2H2O + O2↑
C.电解后,c(Na2SO4)不变,且溶液中有晶体析出
D.电池中c(KOH)不变;电解池中溶液pH变大
10.下列各组离子,一定能在指定溶液中大量共存的是( )
A.使甲基橙变红的溶液中:Fe3+、Na+、NO3-、SO42-
B.水电离出的c(H+)=10-12mol/L的溶液中:NH4+、Na+、NO3-、S2O32-
C.加入碳酸氢铵能放出气体的溶液中:K+、Ca2+、I-、NO3-
D.能使紫色石蕊试液变蓝的溶液中:Na+、Mg2+、Cl-、SO42-
9. 下列说法正确的是( )
A.室温下,HClO分子不可能存在于c(OH-)>c(H+)的溶液中
B.室温下,在pH=7的溶液中,CH3COO-不可能大量存在
C.漂白粉只有在酸的存在下生成次氯酸才具有漂白作用
D.c(CH3COO-)=c(Na+)的CH3COOH和CH3COONa的混合溶液呈中性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com