
题目列表(包括答案和解析)
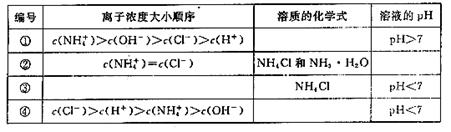
19. (6 分)在室温下,向一定量的稀氨水中逐滴加入物质的量浓度相同的稀盐酸,直至盐酸过量。
请回答下列问题。
(1)在实验过程中水的电离程度的变化趋势是先_______后________;
(填“增大”、“减小”或“不变”)
(2)在下表中,分别讨论了上述实验过程中离子浓度的大小顺序、对应溶质的化学式和
溶液的pH,请将表中空格部分填上相应的内容,将表格补充完整。
18. ( 7 分)将a mol 铜加入到一定浓度的硝酸溶液中,充分反应后,铜完全溶解并产生气
体(不考虑N2 O4 ) 。试回答下列问题:
(1) 硝酸在该反应中表现的性质为_______________________
(2) 当a=0.3 时,则反应中转移的电子数为________mol,若此时收集到的气体在标准状况
下的体积为8.96L,则该气体为__________________。
(3) 用NH3吸收硝酸生产中产生的尾气是一种较为先进的吸收方法,其产物对环境无污染,
目前在工业生产以及汽车尾气处理中已被广泛应用。试写出用NH3恰好吸收(2)所产生气体
的总化学方程式______________________________
17. ( 7 分)由新型无机非金属材料制成的无水冷发动机,热效率高、寿命长。
这类材料中研究较多的是化合物G。
(1)化合物G 的相对分子质量为140,G 中含硅元素,其质量分数为60%,另有元素Y。
G 可以由化合物E(含两种元素)与NH3反应而生成,同时产生HCl 气体。
请推断:G 和E的化学式分别为______________、______________。
(2)粉末状G 能够与氧气反应,所得产物中有一种是空气中的主要成分,另一种是工业
上生产玻璃的主要原料。请写出化合物G 与氧气反应的化学方程式
(3)常压下在G 中添加氧化铝,经高温烧结可制成一种高强度、超硬废、耐磨损、抗腐蚀
的陶瓷材料,它的商品名叫“赛伦”,化学通式可表示为Si6-XAlXOXY8-X。在接近1700℃
时x的极限值约为4.0,在1400℃时 x为2.0,以保持整个化合物呈电中性。推测:
赛伦中以下元素的化合价:Si_______Y______,塞伦的晶体类型__________
16. 镍氢电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。镍氢电池
的总反应式是:H2+2NiO(OH) 2Ni(OH)2 ,根据此反应判断,下列叙述中正确的是
2Ni(OH)2 ,根据此反应判断,下列叙述中正确的是
A.电池放电时,电池负极周围溶液的pH 不断增大
B.电池充电时,阳极反应为:Ni(OH)2 + OH- - e-= NiO(OH) +H2O
C.电池充电时,氢元素被还原
D.电池放电时,负极反应为:H2-2e-=2H+
15.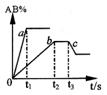 右图是反应A2 +B2
右图是反应A2 +B2 2AB 在不同温度和压强下,AB体积
2AB 在不同温度和压强下,AB体积
分数(AB%)的变化情况,其中a、b 曲线为相同压强、不同温
度时的变化情况,c 曲线在保持与b 相同温度时从时间t3 开
始增大压强的情况,则下列叙述正确的是
A.A2 、B2 、AB 均为气体,正反应放热
B.AB 为气体,A2 、B2 中最少有一种为非气体,正反应放热
C. AB 为气体,A2 、B2 中:最少有一种为非气体,正反应吸热
D.AB 为固体,A2 、B2 中最少有一种为气体,正反应吸热
14. 某溶液中大量存在五种离子:NO3- 、SO42-、Fe3+ 、H+ 、X ,其物质的量之比为:
n(NO3-) :n(SO42-) :n(Fe3+) :n(H+) :n (X) = 2 :3 :1 :3 :1,则X 可能为
A.Fe2+ B. Mg2+ C.Cl- D.Ba2+
13. 下列反应的离子方程式书写正确的是
A. 过量的铁与浓硝酸反应: Fe+6H++3NO3- = Fe3+ 十3NO2↑+3H2O
B. 次氯酸钙溶液中通入过量CO2 :ClO-+CO2 + H2O=HClO+HCO3-
. C. 在碳酸氢镁溶液中加入足量 Ca(OH)2 溶液:
Mg2+ +2HCO3-+Ca2+ +2OH-=MgCO3↓ + CaCO3↓ + 2H2O
D.1mo·L-1 的 NaAlO2 溶液和2.5mol· L-1 的盐酸等体积混合:
2AlO2- + 5 H+=Al(OH)3 ↓+ Al3+ + H2 O
12. 某结晶水合物的化学式为A·H2O,其相对分子质量为B,在60℃时m g 该晶体溶于ng
水中,得到v mL 密度为d g· mL-1 的饱和溶液,下述表达式或判断正确的是
A.该溶液物质的量浓度为(1000m/BV)mol·L-1
B.60℃时A 的溶解度为(100m(B-18)/nB)g
C. 该溶液溶质的质量分数为(m/(m+n))×100%
D.60℃时,将10g A 投入到该饱和溶液中,析出晶体大于l0g
11. 以下离子检验的结论可靠的是
A.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,说明有Ca2+
B. 通入Cl2 后,溶液变为黄色,加入淀粉溶液后溶液变蓝,说明有I-
C. 往溶液中加入盐酸,产生的气体能使澄清石灰水变浑浊,说明有CO32-
D.往溶液中加入 BaC12 溶液和稀 HNO3 ,有白色沉淀生成,说明有SO42-
10. 下列关于反应能量的说法正确的是
A.Zn(s) +CuSO4 (aq) =ZnSO4 (aq) +Cu(s) ; △H =-216kJ·mol-1 ,
反应物总能量>生成物总能量
B.CaCO3 ( s) = CaO(s) +CO2 (g) ;△H = + 178. 5 kJ·mol-1
反应物总能量>生成物总能量
C.l0lkPa 时,2H2 (g)+ O2 (g) =2H2O(1);△H =-571. 6 kJ·mol-1 ,
H2的燃烧热为571.6 kJ·mol'
D.H+ (aq) +OH-(aq) =H2O(l) ;△H=-57.3 kJ·mol-' ,含 1molNaOH 的氢氧化钠
溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com