
题目列表(包括答案和解析)
9、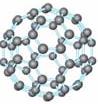 20世纪80年代日本科学家应用电子计算机模拟出结构类似于C60(分子结构如右图所示)的物质N60,计算机模拟结果显示,N60与C60有相似的结构但稳定性较差。科学家预测,将N2进行冷冻或加压,然后运用高强度激光照射能转变为N60分子团,该分子团具有极强的挥发性,在受热情况下瞬间分解为N2并释放出大量的能量。
20世纪80年代日本科学家应用电子计算机模拟出结构类似于C60(分子结构如右图所示)的物质N60,计算机模拟结果显示,N60与C60有相似的结构但稳定性较差。科学家预测,将N2进行冷冻或加压,然后运用高强度激光照射能转变为N60分子团,该分子团具有极强的挥发性,在受热情况下瞬间分解为N2并释放出大量的能量。
已知E(N-N)=167kJ·mol-1,E(N=N)=418kJ·mol-1,E(N≡N)=942kJ·mol-1。(E表示键能,即打开1mol气态化学键所需要的能量)
回答下列问题:
⑴ N60分子中每个N原子最外层有 个电子;
⑵ N60稳定性较差的原因可能是 ;
⑶ 1molN60受热分解为N2时放出的热量为 ;
⑷ N60潜在的商业用途可能是 。
⑴ 8 ⑵ N-N的键能较小 ⑶ 13 230kJ ⑷ 用作高能量的炸药或火箭燃料
8、(1)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成,而是在反应物到生成物的过程中经过一个高能量的过渡态。图甲 是白磷(P4)和O2反应生成P4O10过程中能量变化示意图,请写出白磷(P4)和O2反应生成P4O10的热化学方程式:_________________
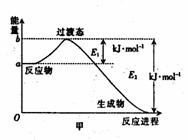 _____________(△H用含E1和E2的代数式表示,其中E1、E2均大于0)。
_____________(△H用含E1和E2的代数式表示,其中E1、E2均大于0)。
(2)白磷(图乙)是正四面体构型的分子,当与氧气作用形成P4O6时,相当于每两个磷原子之间插入一个氧原子(如图丙)。当形成P4O10时,相当于在P4O6的分子中每个磷原子又以双键结合一个氧原子(如图丁)。
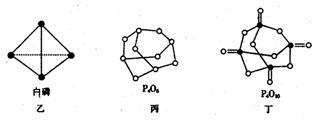
请在图丙的示意图中把磷原子用钢笔或铅笔把磷原子涂黑。
(3)进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关。键能可以简单的理解为断开1mol化学键时所需吸收的能量。下表是部分化学键的键能数据:
|
化学键 |
P-P |
P-O |
O=O |
P=O |
|
键能/kJ·mol-1 |
198 |
360 |
498 |
X |
已知白磷(P4)的燃烧热为2982 kJ·mol-1,白磷完全燃烧的产物结构如图丁所示,则上表中x=________________
(4)写出1molP4与O2反应生成固态P4O6的反应热△H=_____________。
(1)P4(s) + 5O2(g) === P4O10(s); △h=-(E2-E1)kJ·mol-1(2分)
(3)585(2分)
(4)发638kJ·mol-1(2分)
7、发射航天飞机的火箭常用氮的氢化物肼(N2H4)作燃料。试回答下列有关问题:
⑴在结构上N2H4和NH3的关系有如H2O2和H2O的关系。N2H4能发生下列反应:

 N2H4 + H3O+
N2H5+
+ H2O
N2H4 + H2O N2H5+ + OH-
N2H4 + H3O+
N2H5+
+ H2O
N2H4 + H2O N2H5+ + OH-

 N2H5+
+ H2O N2H62+ + OH- N2H5+
+ H2O N2H4 + H3O+
N2H5+
+ H2O N2H62+ + OH- N2H5+
+ H2O N2H4 + H3O+
据此你可得出的结论是 ▲ (填字母)。
A.肼水解显酸性 B.肼在水中电离出H+
C.肼是二元弱碱 D.肼是二元弱酸
⑵ 液态NH3类似H2O,也能微弱电离且产生电子数相同的两种离子,则液态NH3电离方程式为 ▲ 。
⑶ 25℃时,0.2 mol·L-1 氨水与0.2 mol·L-1HCl 溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=a(a<7)。则混合溶液中由水电离出的c(H+) ▲ (填“大于”、“等于”或“小于”) 0.2 mol·L-1HCl 溶液中电离出的c(H+);混合溶液中,c(H+)-c(NH3·H2O)= ▲ (用含有a的关系式表示)。
(1)C (2) 2NH3 NH4+ + NH2
(3)大于 1×10a-14 (每空2分,共8分)
6、不同元素的原子在分子内吸引电子的能力大小可用数值表示,该数值称为电负性。一般认为:如果两个成键元素间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键元素间的电负性差值小于1.7,通常形成共价键。下表是某些元素的电负性值:
|
元素符号 |
Li |
Be |
B |
C |
O |
F |
Na |
Al |
Si |
P |
S |
Cl |
|
电负性值 |
0.98 |
1.57 |
2.04 |
2.55 |
3.44 |
3.98 |
0.93 |
1.61 |
1.90 |
2.19 |
2.58 |
3.16 |
观察上述数据,回答下列问题:
(1)通过分析电负性值变化规律,确定Mg元素电负性值的最小范围 。
(2)请归纳元素的电负性和金属、非金属的关系是 ;
(3)某有机化合物结构中含S-N键,其共用电子对偏向 (写原子名称)。
(4)从电负性角度,判断AlCl3是离子化合物,还是共价化合物的方法是:(写出判断的方法和结论) ;请设计一个实验方案证明上述所得到的结论: 。
(1)0.93-1.57
(2)非金属性越强,电负性越大,金属性越强,电负性越小 (3)氮原子
(4)Al元素和Cl元素的电负性差值为1.55<1.7,所以形成共价键,为共价化合物;
将氯化铝加热到熔融态,进行导电性实验,如果不导电,说明是共价化合物。
5、现有下列短周期元素性质的数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径(10-10m) |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
1.43 |
|
最高或最低化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
–2 |
|
|
–3 |
–1 |
|
–3 |
|
试回答下列问题:
(1)上述元素中处于第VA族的有 ,处于第二周期的有 (以上均用编号表示)。
(2)上述元素中金属性最强的是 (用编号表示)。
(3)写出元素①、⑧形成的化合物与KOH溶液反应的化学方程式 。
(4)经验表明,除氢和氦外,当元素原子的电子层数(n)多于或等于原子最外层电子数(m)即(n–m)≥ 0时,该元素属于金属元素;当元素原子的最外层电子数(m)多于原子的电子层数(n)即(n–m)< 0时,该元素属于非金属元素。试回答:
a.第n(n≥ 2)周期有 种非金属元素(含零族元素)。
b.根据周期表中每个周期非金属元素的种数,预测周期表中应有 种非金属元素(含零族元素)。还有 种未发现,未发现的非金属处在第 周期第
族(注:将零族看作VIIIA族)。
(1)④和⑦(1分)①③⑦(1分) (2)⑥(1分)
(3)Al2O3+2KOH→2KAlO2+H2O(2分)
(4)8–n(1分)。23种(1分),1种(1分),七和VIIIA族(答对其中1个得1分)
4、已知A、B、C、D均为短周期元素,它们的原子序数依次增大。A是最外层为一个电子的非金属元素,C原子的最外层电子数是次外层的3倍;C 和D 可形成两种固体化合物,其中一种为淡黄色固体;B和C可形成多种气态化合物,由A、B、C三种元素可形成离子晶体,该晶体中各元素原子的物质的量之比为A:B:C = 4:2:3,请回答下列问题:
(1)写出C和D形成的淡黄色固体化合物的电子式______________________
(2)元素原子的物质的量之比为A:B:C:D = 4:2:3的晶体名称为____________,其水溶液显____________性,其反应的离子方程式为________________________________
(3)请写出与A2C和BA3分子中电子数相同,且仍由A、B、C元素中任意两种元素组成的粒子的符号(举两例)__________________ ______________________
(4)写出由B、C元素组成元素原子质量比为B:C = 7 :12的化合物的化学式________________.
(1) 略 (2)硝酸铵;酸;NH4++H2O NH3·H2O+H+;
NH3·H2O+H+;
(3)NH4+、H3O+ (4)N2O3;
3、X、Y、Z是短周期元素的三种常见氧化物.X跟水反应后可生成一种具有还原性的不稳定的二元酸,该酸的化学式是________;Y和X的组成元素相同,Y的化学式是________;1 mol Z在加热时跟水反应的产物需要用6 mol的氢氧化钠才能完全中和,Z的化学式是________,其中和产物的化学式是________.在一定条件下,Y可以跟非金属单质A反应生成X和Z,其反应的化学方程式是________.
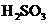 ,(2分)
,(2分)
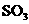 ,(2分)
,(2分) 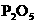 ,(2分)
,(2分)
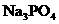 、
、 ,(2分)
,(2分) 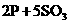
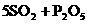 (2分)
(2分)
2、A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同一主族元素,B、D元素的原子核中质子数之和是A、C两元素原子核中质子数之和的两倍,又知四种元素的单质中有两种气体、两种固体。请回答:
⑴C、D组成的常见化合物,其水溶液呈碱性,原因是 ____________(用离子方程式表示)。写出两种均含A、B、C、D四种元素的化合物相互间发生反应,且生成气体的离子方程式 ___________。
⑵D的单质能跟C的最高价氧化物水化物的浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式:
_ ________________________。
⑶A、B、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 。
 ⑴S2-+H2O HS-+OH- HSO3-+H+=H2O+SO2↑
⑴S2-+H2O HS-+OH- HSO3-+H+=H2O+SO2↑
⑵3S+6OH-=2S2-+ SO32-+3H2O
⑶HS-+OH-=S2-+H2O
1、已知A、B、C、D四种短周期元素原子序数依次增大,并依C、D、B、A顺序原子半径逐渐减小。且知A、C同主族,B、D同主族;B、D两原子核外电子数之和为A、C的原子核外电子数之和的两倍;C元素与其它三种元素均能形成离子化合物。试回答下列问题:
(1)元素B的原子结构示意图为__________________。
(2)用电子式表示C、D形成的化合物的形成过程_______________________________。
(3)写出同时含有上述四种元素的化合物反应的离子方程式_______________________。
(4)a、b、c、d、e五种常见共价化合物分子分别由上述四种元素中的两种构成,其中只有a、c、d为三原子分子,c与e分子中原子核外电子数相同,且知a、e均具有漂白性,b、c两分子以一定比例混合共热可得a、d两种分子,试写出有关化学反应方程式:
①a+e:___________________________________________;
②b+c→a+d:_____________________________________。
(1)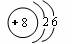
(2)2Na·+∶S∶→Na+[:S:]2-Na+ (3)H++HSO3-=H2O+SO2↑
(4)①SO2+H2O2=H2SO4 ②3SO3+H2S=4SO2+H2O
24.(6分)向Ca(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图所示,试回答:
⑴a点之前反应的离子方程式为
;
⑵c点的二氧化碳体积是 mL;
⑶混合稀溶液中Ca(OH)2和NaOH的物质的量之比
为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com