
题目列表(包括答案和解析)
19、有A、B、C、D、E、F六种元素,已知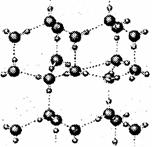 :它们位于三个不同短周期,核电荷数依次增大:A与E、B与F分别同主族;A、E分别都能与D按原子个数比1∶1或2∶l形成化合物;B、C分别都能与D按原子个数比1∶1或1∶2形成化合物。
:它们位于三个不同短周期,核电荷数依次增大:A与E、B与F分别同主族;A、E分别都能与D按原子个数比1∶1或2∶l形成化合物;B、C分别都能与D按原子个数比1∶1或1∶2形成化合物。
(1)写出只含有A、B、D、E四种元素的两种无水盐的化学式_____________、_____________。
(2)右图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示___________,与每个“构成粒子”相邻的粒子呈______________空间构型。A与D按原子个数比l∶l形成的化合物的电子式为__________________。
(3)人们通常把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
|
化学键 |
F-D |
F-F |
B-B |
F-B |
C-D |
D-D |
|
键能/kJ·mol-1 |
460 |
176 |
347.7 |
347 |
745 |
497.3 |
①下列三种物质形成的晶体。熔点由高到低的顺序(用a、b、c表示):_________________
a.F与B形成的化合物 b.B与D形成的稳定化合物 c.F的单质
②试估算F单质品体的燃烧热:_____________________________________
(1)NaHCO3 (1分)CH3COONa(1分)(或其它有机酸的盐)
(2)氢键(1分) 正四面体(1分) HOOH( 2分)
(3)①acb (2分)②990.7kJ/mol(2分)
18、A、B、C、D、E分别属于周期表中前20号元素,其原子序数依次递增,并且其中只有一种金属元素。A是元素周期表所有元素中原子半径最小的;B和C都只有两个电子层,B中一层电子数是另一层的两倍;C中两层电子数之和是两层电子数之差的两倍;D中一层电子数是另两层电子数之和;E的正二价阳离子电子层结构与氩原子相同。
请按要求回答下列问题:
⑴画出E原子的原子结构示意图 ,写出由A和C组成的含有非极性键的化合物的电子式 。
⑵由上述元素组成的化合物中属于极性键构成的非极性分子是
(只要求写出两种,用化学式表示)。
⑶由C与E形成的化合物高温时与单质B反应生成两种化合物,请写出该反应的化学方程式 。
⑷写出上述元素形成的化合物或者单质中:①一种可溶性的正盐与另一种强酸反应的离子方程式 ;②上述元素形成的化合物中通常能污染空气的是 (至少写出两种)。③某一种可污染空气的化合物与强氧化性单质常温下反应生成两种化合物,该反应的化学方程式为 。
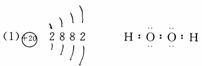 ⑵CH4
、 CO2、CS2
⑵CH4
、 CO2、CS2
⑶CaO+3 C  CaC2+CO↑
CaC2+CO↑
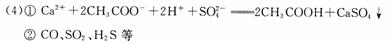
③H2S+O3=SO2+H2 O
17、有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素。已知A、C及B、D分别是同主族元素,且B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍;在处于同周期的C、D、E三元素中,E的原子半径最小;通常条件下,五种元素的单质中有三种气体,两种固体。
(1)B、C两元素按原子个数1:1组成的化合物F中的阴阳离子比为 ,F中既存在离子键又存在 共价键(填“极性”或“非极性”。)
(2)试比较D、E两元素的最高价氧化物对应水化物的酸性强弱(填写化学式):
>
(3)将E单质通入A、B、C三种元素组成的化合物的水溶液中,写出反应的离子方程式: 。
(4)写出两种均含A、B、C、D四种元素的化合物在溶液中相互反应,且生成气体的化学方程式: 。
(1)1:2 非极性
(2)HClO4>H2SO4
(3)Cl2+2OH-=Cl-+ClO-+H2O
(4)NaHSO4+NaHSO3=Na2SO4+H2O+SO2↑
16、随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”。已知钒的原子序数为23,回答下列问题:
(1)钒被认为是一种稀土金属,广泛分布于各种矿物中,钾钒铀矿的化学式为K2H6U2O15(其中钒元素的化合价为+5价),若用氧化物的形式表示,该化合物的化学式为__________.
(2)测定钒含量的方法是先把钒转化为V2O5,V2O5在酸性条件下转化为VO2+,再用盐酸、硫酸亚铁、草酸等测定钒.请配平下列化学方程式:
___VO2++___H2C2O4→___VO++___CO2+___H2O,
其中还原剂是_________,若反应消耗0.9g草酸,则反应过程中转移的电子数目为________.
(1)K2O·V2O5·2UO3·3H2O
(2)1,1,1,2,1;H2C2O4;1.204 1022
1022
15、已知X、Y、Z、W四种元素是元素周期表中连续三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z二种元素的元素符号:X_________Z__________
(2)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物的电子式分别为__________________、___________________、___________________
(3)由X、Y、Z所形成的常见离子化合物是___________,它与W的最高价氧化物的水化物的浓溶液加热时反应的离子方程式_______________________________________________
(4)在由X、Y、Z、W四种元素形成的常见化合物或单质中,不能形成的晶体类型是_________.
(1)H O
(2)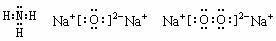 (共3分)氮化钠氢化钠也对
(共3分)氮化钠氢化钠也对
(3) NH4NO3 NH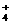 +OH―
+OH― NH3↑+H2O (4分)
NH3↑+H2O (4分)
(4)原子晶体 (2分)
14、科学家从化肥厂生产的(NH4)2SO4中检出组成N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子形式存在,植物的根系极易吸收N4H4+4,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。请回答下列问题:
⑴ N4和N2的关系正确的是___________(填序号);
A.同种单质 B.同位素 C.同分异构体 D.同素异形体
⑵ N4H4(SO4)2______ (填“能”或“不能”)和草木灰混合施用;
⑶ 已知白磷、NH4+、N4H44+的空间构型均为四面体,NH4+的结构式为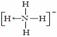 (→ ,表示共用电子对由N原子单方面提供),白磷(P4)的结构式为
(→ ,表示共用电子对由N原子单方面提供),白磷(P4)的结构式为 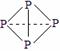 ,请画出N4H44+的结构式 。
,请画出N4H44+的结构式 。
⑷ 已知液氨中存在着平衡2NH3 NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:__________________________________________。
NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:__________________________________________。
(1)D (2分)(2)不能 (2分) (3)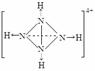 (3分)
(3分)
(4)8NH3 + 4CsOH = N4 + 4CsNH2 + 6H2↑+ 4H2O(3分)
13、A、B、C、D四种短周期元素,原子序数依次增大,离子半径依次减小,A与C可形成原子个数比分别为l∶1和1∶2的两种离子化合物,A与D的原子序数之和等于B与C的原子序数之和,请回答下列问题:
(1)写出元素符号:B________,D________。
(2)A、C形成的离子化合物与CO2发生氧化还原反应的化学方程式:________。
(3)1 mol C的氢氧化物与1 mol B单质在一定条件下恰好完全反应,生成一种盐、水及一种气体,写出该反应的化学方程式:________________________________________________________。
(4)B、C形成的化合物溶于水时,溶液中所有离子的物质的量浓度由大到小的顺序为_________________________________________________。
(1)F、Mg;(2)2Na2O2+2CO2=2Na2CO3+O2;(3)2F2+2NaOH=2NaF+H2O+OF2;(4)c(Na+)>c(F-)>c(OH-) >c(H+)
12、二氧化钛最重要的用途是用于制造钛的其他化合物。由二氧化钛直接制取金属钛是比较困难,原因是二氧化钛的热稳定性很强。例如:用碳还原二氧化钛,即使在高温1800℃也难反应。现用钛铁矿石为原料,经过一系列的反应制得颜料钛白粉(TiO2),其工业流程大致如下:
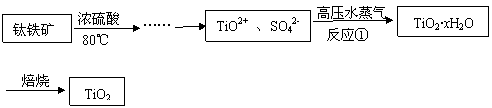
(1)反应①的离子方程式为 ,高压水蒸气的作用是
。
(2)用金红石主要成分(TiO2)制取颜料钛白粉(TiO2),涉及的工业流程大致如下:
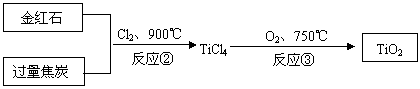
反应②的化学方程式 。
反应③的化学方程式 。
(1)TiO2++(x+1)H2O
 TiO2·xH2O
+2H + (3分)
TiO2·xH2O
+2H + (3分)
提供水解所需要的大量水和热量,促进水解趋于完全。(3分)
(2) TiO2+2Cl2+2C 900℃ TiCl4+2CO (2分)
TiCl4+O2 750℃ TiO2 + 2Cl2 (2分)
10、第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
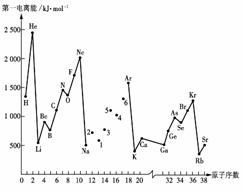
请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,将Na--Ar之间六种元素用短线连接起来,构成完整的图像。
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是______________;
(3)上图中5号元素在周期表中的位置是________________________________________;
(4)上图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:__________________________________。
(1)见上图(右)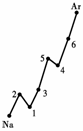 (2分)
(2分)
(2)从上到下依次减小 (2分)
(3)第三周期,ⅤA族 (2分)
(4)因同主族上一周期的元素的氢化物分子间存在氢键 (2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com