
题目列表(包括答案和解析)
1.高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
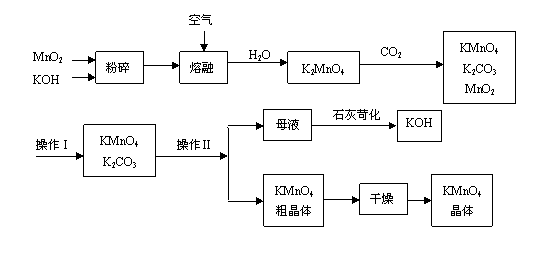
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是______(填代号)。
a. 84消毒液(NaClO溶液) b. 双氧水 c. 苯酚 d. 75%酒精
(2)高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是_______(填代号)。
a. 浓硝酸 b. 硝酸银 c. 氯水 d. 烧碱
(3)上述流程中可以循环使用的物质有 、 (写化学式)。
(4)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得 mol KMnO4。
(5)该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2,所需试剂最好选择(选填代号) 。
a. 石灰石 b. 稀HCl c. 稀H2SO4 d. 纯碱
所需气体发生装置是 (选填代号)。


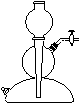
A B C
(6)操作Ⅰ的名称是 ;操作Ⅱ根据KMnO4和K2CO3两物质在 (填性质)上的差异,采用 (填操作步骤)、趁热过滤得到KMnO4粗晶体。
29.(1)原子形成化合物时,电子云间的相互作用对物质的结构与性质会产生影响。试回答:
①BF3分子的立体结构为 形,NF3 分子的立体结构为 形;
②碳原子有4个价电子,在有机化合物中价电子均参与成键,但杂化方式不一定相同。在乙烷、乙烯、乙炔分子中,碳原子进行sp3杂化的分子是(写结构简式) ,存在一个π键的分子是(写名称) ;
③H2O、NH3、CH4分子中键角由大到小的顺序为 ,原因是 ;
(2)下图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:
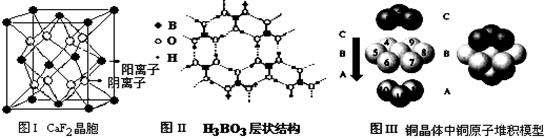
①图I所示的CaF2晶晶体中与Ca2+最近且等距离的F-数为 ,图III中未标号的铜原子形成晶体后周围最紧邻的铜原子数为 ;
②图II所示的物质结构中最外能层已达8电子结构的原子是 ,H3BO3晶体中B原子个数与极性键个数比为 。
28.甘油松香酯是应用最广泛的一种松香酯,俗称酯胶,是由甘油与松香反应而得的。松香的结构简式如图1所示:
(1)试写出松香的化学式:
(2)若用R-COOH来表示松
香的结构简式,试写出生成甘油三松香酯的反应方程式: ;
(3)若1mol松香分子与1mol Br2反应,再在NaOH的醇溶液中发生反应后,再酸化可得如图2所示的物质。试写出松香分子与Br2反应生成的产物的结构简式: ;
(4)若已知苯环侧链上的第一个碳原子上有氢原子的话,不论侧链有多长,都会被酸性高锰酸钾氧化成羧基,则如图3所示的物质在酸性高锰酸钾溶液中充分反应后的产物中含有苯环结构的物质的结构简式为: 。
27.(10分)A和B两种物质的分子式都是C7H6O2,它们都能跟氢氧化钠溶液发生反应,A能发生银镜反应而B不能,A还能与溴水反应,1molA与足量溴水反应时消耗2mol Br2 ,B能与碳酸氢钠溶液反应放出CO2 。由A转化为B的过程可表示如下。试回答下列问题:
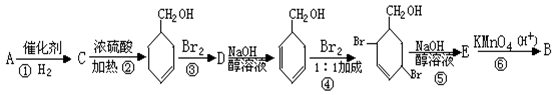
(1)写出有机物的结构简式:C 、D ;
(2)写出化学反应方程式:A与溴水的反应:
B与E在浓硫酸存在下的反应:
(3)在A转化为B的过程中第④步反应若溴水足量,再进行第⑤步反应,则生成的产物中可能含有碳碳叁键,试写出其含有碳碳叁键的物质的结构简式(有几种写几种) 。
26.(10分)取一定质量的NaBr、NaI的混合物平均分成五等份,分别加水配成溶液并编号为甲、乙、丙、丁、戊,在分别向各溶液中通入一定体积的氯气,将反应后所得溶液蒸干、灼烧得固体,通入氯气的体积与最终所得固体质量记录如下:
|
编号 |
甲 |
乙 |
丙 |
丁 |
戊 |
|
固体组成 |
|
NaI NaBr NaCl |
|
|
NaCl |
|
氯气的体积/mL |
V |
2V |
3V |
4V |
5V |
|
固体质量/g |
54.62 |
43.64 |
35.48 |
30.14 |
29.25 |
(1)请填写表中空白;(2)标准状况下氯气的体积V为 ,原混合物中NaBr的物质的量为 。
25.(11分)有五种短周期主族元素A、B、C、D、E,已知:五种元素原子序数依次增大,其中A、E的单质在常温下是气体,B元素原子的最外层电子数是电子层数的2倍,D元素的单质常用于野外焊接铁轨,C元素是所在周期主族元素中原子半径最大的一种。
(1)试写出A、B两种元素形成的不含有非极性键的化合物的电子式: ;
(2)试写出工业上用电解方法冶炼D单质的化学方程式 ;
(3)写出C单质在空气中燃烧的化学方程式,并标出电子转移的方向和数目:
;
(4)写出实验室制取单质E的化学方程式: 。
24.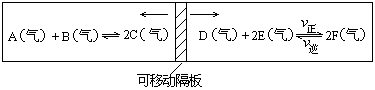 (8分)在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应。各物质的起始加入量如下:A、B、C和E均为2.0摩,设D为x摩、F为y摩。当x、y在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置。
(8分)在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应。各物质的起始加入量如下:A、B、C和E均为2.0摩,设D为x摩、F为y摩。当x、y在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置。
(1)若x=1、y=3,
反应 (填A.正向
进行 B.逆向进行C.已达
平衡状态)。其理由是
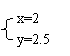
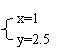 。
。
(2)若 与 , 则在这两种情况下,当反应达平衡时,A的物质的量是否相等?
(填A相等、B不相等或C不能确定).其理由是: 。
23.(10分)高中化学中学教材有如图3所示的铜与浓硫酸反应实验装置,该实验过程中会有二氧化硫气体放出,污染室内空气,严重地
损害师生健康.为此某课外小组对此实验
进行如图4所示的改进,改进的实验操作
简单现象明显,并且几乎无二氧化硫气体
泄漏。实验步骤如下:①首先按装置图安
装仪器,安装仪器时,在支管胶塞的铁丝
构上挂一片品红试纸。②向试管中加入约10 图3 图4
毫升的浓硫酸,加热(在加热浓硫酸时,将铜片向上提起,铜片先不要伸入浓硫酸中),当加热至沸腾时,把铜片放下,使其完全浸入浓硫酸中,反应即刻发生。等不需要反应时停止加热并将铜片提起,离开浓硫酸,反应就停止了。
回答下列问题:
(1)如图4所示,铜片与沸腾的浓硫酸接触后可看到的现象有: ;
(2)塑料袋作用是: ;
(3)为了防止反应结束后留在试管中的气体和塑料袋中的气体污染环境,可进行的操作是:
。
相关的离子方程式是: 。
22.(10分)某实验小组设计用50mL1.0mol/L盐酸跟50mL1.1 mol/L
氢氧化钠溶液在下图装置中进行中和反应。在大烧杯底部垫泡沫塑
料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在
大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板
(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形
玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。
试回答下列问题:
(1)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和。试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热数值 (填偏高、偏低或不变);
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据。
|
实验序号 |
起始温度t1/℃ |
终止温度(t2)℃ |
温差(t2-t1)℃ |
||
|
盐酸 |
NaOH溶液 |
平均值 |
|||
|
1 |
25.1 |
24.9 |
25.0 |
31.6 |
6.6 |
|
2 |
25.1 |
25.1 |
25.1 |
31.8 |
6.7 |
|
3 |
25.1 |
25.1 |
25.1 |
31.9 |
6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3中和后混和液的比热容 C=4.18J/(g·℃)则该反应的中和热为△H=___________________________________;
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热的数值会 (填偏高、偏低或不变),其原因是 ;
(4)影响中和热测定结果的关键因素在于: 。
21.(10分)
⑴(3分)下列做法存在安全隐患的是 (选填序号)
A.氢气还原氧化铜实验中,先加热氧化铜后通氢气
B.皮肤上沾有少量浓硝酸时,立刻用大量水冲洗,再涂上稀碳酸氢钠溶液
C.实验室做关于钠的实验时,余下的钠屑投入到废液缸中
D.制乙烯时,用量程为300℃的温度计代替量程为200℃的温度计,测反应液的温度
E.蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拔开橡皮塞并投入碎瓷片
F.配制浓硫酸与酒精混合液时,将1体积的酒精倒入3体积的浓硫酸中
(2)(8分)①实验室可利用下图1所示
装置来制取气体 (写出两
种常见气体的化学式);②已知草酸(乙
二酸)在受热时发生如下分解反应:
H2C2O4
 CO↑+CO2↑+H2O↑。
CO↑+CO2↑+H2O↑。
某同学拟用图1的改进装置图2来验
证上述反应中有CO2和H2O生成。 图1 图2
已知:草酸晶体的化学式为:H2C2O4·2H2O,熔点为100.1℃,分解温度约为170℃-180℃。试结合所学知识,指出3处该实验设计中的不足之处a:
b: c: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com