
题目列表(包括答案和解析)
21.某资料说铁锈的成分为Fe2O3·H2O和FeCO3的混合物。根据此记载,某实验兴趣小组设计下列实验来验证其中是否含有碳酸亚铁。
①取一高度腐蚀的干燥铁钉,称其质量为10.04g,在氮气保护下,充分加热,冷却后称得质量为8.92g。(不考虑铁与水蒸气的反应及Fe2O3在高温下的分解反应,且铁钉中不含有其它杂质)
②将①得到的残渣投入到5.00mol/L的硫酸中,不断添加硫酸直至残渣完全溶解时,恰好用去硫酸31.00mL。整个过程无气体放出。则:
⑴铁锈中 (填“含有”或“不含有”)碳酸亚铁,理由是
。
⑵锈蚀的铁钉中Fe2O3·H2O的质量为 。
⑶锈蚀前铁钉的质量至少为 。
20.实验证明,C还原CuO时既可能生成Cu,也可能生成Cu2O,即使在C过量时,实验中CuO也可能部分未被还原。为了测定某次实验产物的组成,取1.2 g C跟8.0 g CuO混合,加热后将反应生成的气体通过足量的澄清石灰水。一段时间后停止加热,共收集到560 mL气体(已经折算成标准状况),测得沉淀的质量为2.5 g。则:
⑴ 上述实验中C (填“完全”或“不完全”)参加反应,实验中收集到的气体是 (填写化学式),产生这种气体的化学方程式为 。
 ⑵ 反应后得到的固体混合物总质量为 ,其中含氧化合物的物质的量为 。
⑵ 反应后得到的固体混合物总质量为 ,其中含氧化合物的物质的量为 。
⑶被还原生成Cu2O的CuO占总CuO的物质的量分数为x,试通过计算求出反应中生成Cu的质量[m(Cu)]与x的关系。
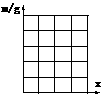
⑷ 请在右图中画出m随x变化的图像。
19.一定温度下,难溶电解质的饱和溶液中各离子浓度幂的乘积是一个常数,这个常数称为该难溶电解质的溶度积,用符号Ksp表示。如:AmBn(s)  mAn+(aq)+nBm-(aq), Ksp(AmBn) = c(An+)m·c(Bm-)n
mAn+(aq)+nBm-(aq), Ksp(AmBn) = c(An+)m·c(Bm-)n
已知:某温度时,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12
试求:
⑴此温度下AgCl饱和溶液的物质的量浓度为 ,Ag2CrO4饱和溶液的物质的量浓度为 。
⑵此温度下,在0.010mo1·L-1的AgNO3溶液中,AgCl与Ag2CrO4分别能达到的最大物质的量浓度分别为 , 。
18.(Ⅰ)常温下将体积为v1、浓度为c1的一元酸HA与体积为v2、浓度为c2的一元碱MOH混合。
⑴若v1·c1=v2·c2,混合后的溶液pH>7,则一元弱酸的电离程度 (选填“>”、“<”或“=”)一元弱碱的电离程度;
⑵若v1=v2,一元弱碱的电离程度大于一元弱酸的电离程度,且混合后溶液pH<7,则c1 c2(选填“>”、“<”或“=”)
(Ⅱ)现有常温下的六份溶液:①0.01mol/LCH3COOH溶液;②0.01mol/LHCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol/LCH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01mol/LHCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
⑴其中水的电离程度最大的是 (选填序号,下同),水的电离程度相同的是 ;
⑵若将②、③混合后所得溶液pH=7,则消耗溶液的体积:② ③(选填“>”、“<”或“=”);
⑶将六份溶液稀释相同倍数后,溶液的pH:① ②,③ ④,⑤ ⑥(选填“>”、“<”或“=”);
⑷将①、④混合,若有c(CH3COO-)>c(H+),则混合液可能呈 。
A.酸性 B.碱性 C.中性
化学计算专题
17.已知当溶液的pH在10左右时,铝元素主要以Al(OH)3形式存在。如果饮用水中含有一定浓度的NO3-将对人类健康产生危害,NO3-能氧化人体血红蛋白中的Fe(Ⅱ),使其失去携氧功能:NO3-还能被水中还原性物质还原成具有强烈致癌作用的NO2-。为此世界卫生组织规定饮用水中NO3-含量(以N计)必须小于10mg/L。为了降低饮用水中NO3-的浓度,某研究人员提出以下3种方案:
a、微碱性条件下用Fe2+还原,还原产物为NH3。
b、pH=10.25时,用铝粉还原,NO3-的还原产物主要为N2。
c、在催化剂作用下用氢气还原,还原产物主要为N2。
(1)请写出a方案的相关反应的离子方程式。
(2)b方案中最好用 调节pH 。
A.NaOH B.CaO C.NH3·H2O
理由是 。
(3)与a、b方案相比,c方案的优点是:
16.工业上可利用反应:CH4(g)+H2O(g) CO(g)+3H2(g) ,生产合成氨原料气H2。
CO(g)+3H2(g) ,生产合成氨原料气H2。
已知温度、压强和水碳比[ ]对甲烷蒸气转化反应的影响如下图:
]对甲烷蒸气转化反应的影响如下图:

图1(水碳比为3) 图2(水碳比为3) 图3(800℃)
该反应平衡常数K=c(COH2
(1)升高温度,平衡常数K__________(选填“增大”、“减小”或“不变”,下同)。
(2)图2中,两条曲线所示温度的关系是:t1_____t2(选填>、=或<);在图3中画出压强为2 MPa时,CH4平衡含量与水碳比之间关系曲线。
(3)工业生产中使用镍作催化剂。但要求原料中含硫量小于5×10-7%,其目的是__________
15.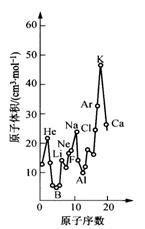 下图为周期表中原子体积(单质原子的摩尔体积) 随原子序数变化的关系。
下图为周期表中原子体积(单质原子的摩尔体积) 随原子序数变化的关系。
(1)第二周期原子体积最大的元素形成的固态单质属于_________________晶体。
(2)试预测下列元素原子体积的关系:Se _____ Br;Xe _____ Ba(选填 >、 = 或 < )。
(3)从图中可以得出的结论有__________(选填代 号)。
a. 同一周期中,原子体积先由大变小,而后又由小变大
b. 每一周期中,碱金属的原子体积最大
c. 同一主族中从上到下,原子体积一般总是逐渐减小
(4)由此可见,在元素周期表中,元素性质与它们所形成的单质和化合物的性质均有周期性变化规律。试写出一条Ⅶ族元素所形成的化合物某种性质的变化规律: ____________________。
14.已知:C2H5OH+HO-NO2(硝酸)  C2H5O-NO2(硝酸乙酯)+H2O
C2H5O-NO2(硝酸乙酯)+H2O
RCH(OH)2  RCHO+H2O
RCHO+H2O
现有只含C、H、O的化合物A~E,其中A为饱和多元醇,其它有关信息已注明在下图的方框内。
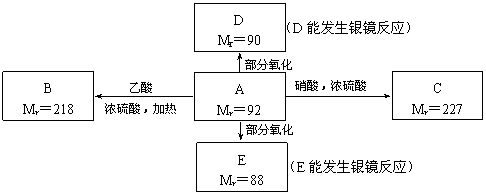
回答下列问题:
(1) A的分子式为 。
(2) 写出下列物质的结构简式:B ;D 。
(3) 写出下列反应的化学方程式和反应类型(括号内):
A→C: ,( );
A→E: ,( )。
(4) 工业上可通过油脂的皂化反应得到A,分离皂化反应产物的基本操作是 。
化学基本概念基本理论专题
13. 烯烃通过臭氧氧化并经锌和水处理得到醛或酮,例如:
烯烃通过臭氧氧化并经锌和水处理得到醛或酮,例如:
一种链状单烯烃A通过臭氧氧化并经锌和水处理得到B和C。化合物B含碳69.8%,含氢11.6%,B无银镜反应。D在浓硫酸存在下加热,可得到能使溴水褪色且只有一种结构的物质E。G的分子式为C7H14O2。有关转化关系如下:
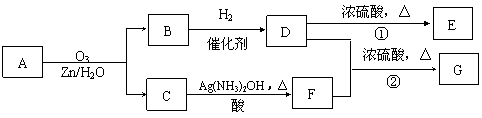 (1)B的相对分子质量是__________________。
(1)B的相对分子质量是__________________。
(2)写出结构简式:A__________________、E_______________________。
(3)写出反应①、②的反应类型:①________________、②_______________。
(4)写出反应②的化学方程式:__________________________________________。
(5)F的一种同分异构体能发生酯化反应和银镜反应,其结构简式为___________________。
12.现有一烃A,它能发生下图所示的变化。
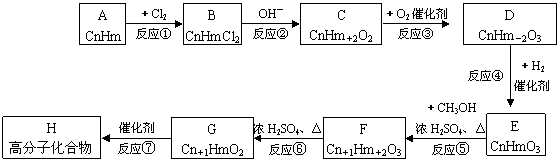
已知E分子间发生缩合反应,可生成环状化合物C6H8O4,回答下列问题:
(1)A的结构简式为 ,C的结构简式为 _,
D的结构简式为 ,E的结构简式为 。
(2)在①~⑥的反应中,属于加成反应的是_____________________________(填序号)。
(3)写出下列反应的化学方程式(有机物写结构简式):
F→G: ;
G→H: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com