
题目列表(包括答案和解析)
19.
[命题意图]
与本届学生所使用的教材相比,在实施新课程标准的高二学生所使用的《化学反应原理》(选修4)中增加了《难溶电解质的溶解平衡》一节,本题通过信息给予的方式力求让学生对难溶电解质的溶解平衡有初步的认识,培养学生接受新信息的能力,并能将“勒沙特列原理”迁移运用到弱电解质的溶解平衡这一动态平衡中。
[参考答案]
(1)1.3×10-5 mol/L ,6.5×10-5 mol/L
(2)c(AgCl)= 1.8×10-8 mol/L c(Ag2CrO4)=1.1×10-8 mol/L
[解析]
⑴AgCl(s) 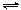 Ag+(aq) + Cl-(aq)
Ag+(aq) + Cl-(aq)
x x
Ksp(AgCl) = x·x =1.8×10-10(mol/L)2
c(AgCl)=x =1.3×10-5 mol/L
Ag2CrO4(s)  2Ag+(aq) + CrO42-(aq)
2Ag+(aq) + CrO42-(aq)
2y y
(2y)2·y= Ksp(Ag2CrO4) = 1.1×10-12 (mol/L)3
c(Ag2CrO4)=y=6.5×10-5 mol/L
⑵在0.010 mol·L-1 AgNO3溶液中,c(Ag+)=0.010 mol·L-1
AgCl(s)  Ag+(aq) + Cl-(aq)
Ag+(aq) + Cl-(aq)
溶解平衡时:0.010 mol·L-1+x x
18.
[命题意图]
从较小的切口,考查电解质溶液部分的核心内容:弱电解质的电离平衡,影响水的电离平衡的因素,影响盐类水解的因素,等物质的量浓度的强电解质和弱电解质溶液稀释后pH的变化与等pH的强电解质和弱电解质溶液稀释后pH变化的区别,溶液中粒子浓度的大小的比较方法等。
[参考答案]
(Ⅰ)⑴< ⑵> (Ⅱ)⑴⑥ ②③④ ⑵> ⑶> > > ⑷ABC
[使用与讲评建议]
本题可以作为电解质溶液专题复习的例题或习题。电解质溶液是基本理论部分的重点,也是历年高考的热点和难点。在讲评时,一方面要让学生加深对强电解质、弱电解质、水的电离、pH等的认识,理解影响弱电解质电离平衡的因素、影响盐类水解平衡的条件和稀释规律,另一方面要强化正确的思维方法,如溶液中粒子浓度大小比较的科学的思维方法等。
化学计算专题
17.
[命题意图]
本题重点考查根据反应信息书写化学方程式、离子方程式的能力及评价实验方案的能力。
[参考答案]
(1)8Fe(OH)2+NO3-+6H2O=8Fe(OH)3+NH3↑+OH-
(2)B 引入的Ca2+对人体无害且易被除去,并且价格便宜。
(3)c中还原剂来源广泛,氧化产物为水,既不污染环境又不会引入对人体有害的铝离子。
[使用与讲评建议]
重点训练学生理解分析信息的能力、方案评价能力及规范书写化学用于的技能。结合此题,可拓展介绍:
(1)含Cr废水(Cr以Cr2O72-形式存在)等的处理方法。电解法利用铁做阳极产生的亚铁离子作为还原剂与Cr2O72-发生氧化还原反应,使Cr2O72-还原为Cr3+,进一步转化为Cr(OH)3沉淀。
(2)电浮选凝聚法是工业上采用的一种污水处理方法,电解污水实验装置如右图所示。
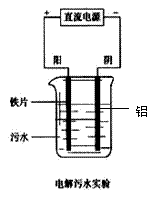 试写出电极反应及总反应式:
试写出电极反应及总反应式:
阳极反应_________________________
阴极反应________________________
总反应:
简述电浮选净化原理:
参考答案:
阳极反应Fe -2 e - = Fe 2+
阴极反应2H + + 2 e - = H2↑
总反应:Fe + 2H2O Fe(OH)2 + H2↑
4Fe(OH)2 + O2 + 2H2O =4Fe(OH)3
或 4Fe + 10H2O + O2 = 4 Fe(OH)3 + 4H2↑
电浮选净化原理:通直流电后,阳极铁失去电子生成亚铁离子,并进一步被氧化生成氢氧化铁,氢氧化铁有吸附性,可吸附污物而沉淀下来,具有净化的作用;阴极产生氢气,气泡把污水中的悬浮物带到水面形成浮渣层,积累到一定厚度时刮去(或撤掉)浮渣层,及起到了浮选净化的作用。
16.
[命题意图]
本题考查化学平衡的有关知识、作图的能力。
[参考答案]
(1)增大
(2)<
(3)防止催化剂中毒
[使用与讲评建议]
进一步复习巩固可逆反应到达化学平衡状态的判断方法,恒温、恒容及恒温、恒压下的等效平衡,化学平衡的移动。
15.
[命题意图]
本题结合原子体积考查元素周期律。
[参考答案]
(1) 分子; (2)<、> (3)a; (4)从上到下,气态氢化物稳定性逐渐减弱(答
案合理即给分)
[使用与讲评建议]
(1)通过此题进一步复习巩固课本中元素周期律的有关知识。
(2)拓展介绍元素第一电离能、电负性等随原子序数的递增而呈现的周期性变化规律。
14.
[命题意图]
本题考查根据酯化反应的定义、有机物相对分子质量之间的关系、有机反应条件等信息进行有机物推断的能力。
[参考答案]
(1)C3H8O3;
(2)
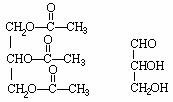
(3)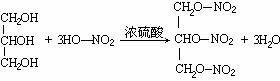 ,酯化反应(或取代反应);
,酯化反应(或取代反应);
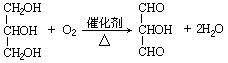 ,氧化反应;
,氧化反应;
(4)盐析,过滤。
[使用与讲评建议]
要注意伴随着官能团结构的变化有机物的相对分子质量也在有规律地变化,有时往往成为解题的突破口。由一个醇羟基变成硝酸乙酯,酯相对分子质量比醇增加45,所以A中有(227-92)/45=3个羟基,92-3×17=42,推出残基为C3H5,结合信息②可知A为丙三醇。
化学基本概念基本理论专题
13.
[命题意图]
本题要求根据烯烃、醛、酮、醇、酸、酯的结构与性质及烯烃通过臭氧氧化并经锌和水处理得到醛或酮的信息进行推断,考查学生有机化学知识、信息学习能力及有机推断能力。
[参考答案]
(1)86;
(2)A: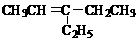 ;E :
;E : ;
;
(3)消去反应、酯化反应;
(4)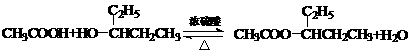 ;
;
(5)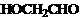 。
。
[使用与讲评建议]
重点复习从元素质量分数、有机物相对分子质量确定有机物分子式的一般方法以及根据有机反应条件及信息进行推断的方法。
12.
[命题意图]
本题以烯烃、卤代烃、醇、醛、酮、酸、酯、聚合高分子化合物等的相互转化为线索,考查了烃、烃的含氧衍生物及高分子之间的相互转化推断能力。
[参考答案]
(1)CH3CH=CH2,CH3CHOHCH2OH,CH3COCOOH,CH3CHOHCOOH。
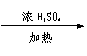 (2)①④。
(2)①④。
(3)CH3CHOHCOOCH3 CH2=CHCOOCH3+H2O
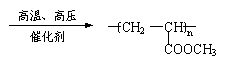
nCH2=CHCOOCH3
[使用与讲评建议]
(1)本题可作为有机推断专题复习例题或练习。通过此题进一步巩固复习烃、烃的含氧衍生物及高分子之间的相互转化等有机化学的主干知识,提高解决有机框图题的能力。
(2)由反应①可知A含有一个碳碳双键;由E分子间发生缩合反应,可生成环状化合物C6H8O4,可知E有3个碳原子,进一步推得A有3个碳原子。
10.
[命题意图]
本题以烯烃、苯的同系物、卤代烃、醇、醛、酸、酯的结构和性质为知识载体,考查学生利用新信息(羟醛缩合等)解决有机推断、有机合成问题的综合分析、推理创新能力。
[参考答案]
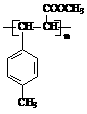
(1)A: I:
(2)加成反应 强碱的醇溶液、加热
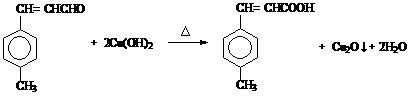
(3)
(4) 6种
(5)
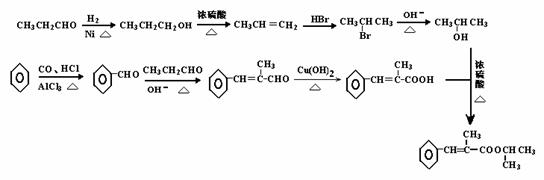
(由丙烯水合得到异丙醇也可)
[使用与讲评建议]
(1)本题可作为有机物推断及有机合成专题复习例题或练习。通过此题进一步复习烯烃、苯的同系物、卤代烃、醇、醛、酸等有机物的有关性质,巩固重要有机反应方程式的书写,进一步强化同分异构体的书写,使学生进一步明确:根据有机物的转化关系推断有机物可以根据特定的反应条件进行分析,并总结中学化学常见的有机反应类型所需要的反应条件;另一个规律是中学化学常见的有机物相互转化的推断中,苯环一般不发生变化。有机合成的关键是碳骨架的构建、官能团的引入与转化。
(2)如何推A应作为本题的关键。从D的分子式C10H10O入手,可推出B中有8个碳原子,又由于D中只有1个氧原子,进一步可推出A为甲苯。
(3)写D属于酚类的同分异构体,可从不饱和度加以考虑,应注意其结构无其他环。此题可作如下变化拓展:“且苯环上只有两种取代基”。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com