
题目列表(包括答案和解析)
1.生活中的一些问题常涉及到化学知识,下列叙述不正确的是
A.甘蔗渣可经化学反应制得酒精
B.福尔马林是一种良好的杀菌剂,但不可用来消毒饮用水
C.棉花和蚕丝的主要成份都是纤维素
D.目前我国空气质量日报中,被列为空气污染物的有SO2、NO2和可吸入颗粒物
24(8分)在20 ℃时食盐的溶解度为36 g,取一定量该温度下的饱和食盐水用惰性电极进行电解,当阳极析出气体5.6 L(标准状况)时,食盐刚好电解完。试计算:
(1)电解时所取饱和食盐水的质量是多少克?
(2)要使溶液恢复到原状态,需要加入 克的 (填物质名称)
25.(10分)取一定量的Fe、Cu的混合物粉末,平均分成五等份,分别向每一份中加入一定量的稀硝酸,实验中收集到的NO气体的体积及所得剩余物的质量记录如下(所有体积均在标准状况下测定):
|
实验序号 |
① |
② |
③ |
④ |
⑤ |
|
硝酸体积 |
100mL |
200
mL |
300
mL |
400
mL |
500
mL |
|
剩余物的质量 |
17.2g |
8 g |
0 g |
0 g |
0 g |
|
气体体积 |
2.24L |
4.48L |
6.72L |
7.84L |
7.84L |
⑴该实验中所用硝酸的物质的量浓度为_____________。
⑵第①次实验后所得剩余物的成分是_________________(填化学式,无需算出各成分质量,下同)、第②次实验后所得剩余物的成分是_________________。
⑶求实验中每次所取混合物中铜的质量。
23、在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧进行如图所示的反应(均加有适量的新型固体催化剂,其体积可忽略不计)
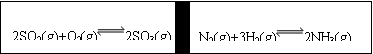
⑴若其始时左侧投入2molSO2、1molO2,右侧投入1molN2、4molH2,达到平衡后(两侧温度相同),隔板是否可能在、仍处于中央 (填“可能或不可能”)
⑵起始时投入2molSO2、1molO2;1molN2、2molH2,达到平衡后,隔板仍处于中央,则SO2的转化率和N2的转化率之比为 (填数字)
⑶若起始时投入2molSO2、1molO2;1molN2、amolH2、0.1molNH3,起始时右侧体积小于左侧体积,当a值在一定范围内变化时,均可通过调节反应器温度,使左右两侧反应都达到平衡,且平衡时隔板处于中央,此时SO2的转化率与N2的转化率之比为5:1,求a的取值范围
⑷若起始时投入2molSO2、1molO2,欲用简单方法粗略测定平衡时SO2的转化率,则可将左侧的平衡混合气体中通入足量的 (填序号)
A、碳酸钠与碳酸氢钠混合溶液 B、氯化钡溶液
C、98.3%的浓硫酸 D、硝酸钡混合溶液
22.
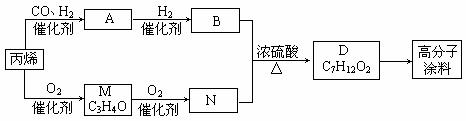 (12分)有一种广泛用于汽车、家电产品上的高分子涂料,按下列流程图生产。流程图中M(C3H4O)和A都可以发生银镜反应,N和M的分子中碳原子数相等,A的烃基上一氯取代位置有三种。
(12分)有一种广泛用于汽车、家电产品上的高分子涂料,按下列流程图生产。流程图中M(C3H4O)和A都可以发生银镜反应,N和M的分子中碳原子数相等,A的烃基上一氯取代位置有三种。
填写下列空白:
⑴物质的结构简式:A___________________,高分子涂料______________________。
⑵写出下列转化的反应类型:A→B________________,B→D_______________。
⑶写出下列反应的化学方程式:
A发生银镜反应:_______________________________________________,
B与N反应生成D:_______________________________________________。
21.(6分)聚氨酯是主链上含有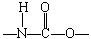 重复结构单元的一种新型高分子化合物,在高档家具所用底发泡材料方向用途广泛。其单体是异氰酸酯(如O=C=N–R–N=C=O)和多元醇(如HO–R’–OH),高聚物结构简式为:
重复结构单元的一种新型高分子化合物,在高档家具所用底发泡材料方向用途广泛。其单体是异氰酸酯(如O=C=N–R–N=C=O)和多元醇(如HO–R’–OH),高聚物结构简式为: 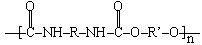 。
。
(1)由上述异氰酸酯和多元醇合成高聚物的反应类型为_____________。
(2)某聚氨酯类高聚物结构简式为: ,它由异氰酸酯A和多元醇B形成,则A和B的结构简式为:A_______B________。
,它由异氰酸酯A和多元醇B形成,则A和B的结构简式为:A_______B________。
20.(12分)物质的转化关系如下图所示,其中甲可由两种单质直接化合得到,乙为金属单质,F的溶液中只含一种溶质,G为酸,乙在G的浓溶液中发生钝化。有的反应可能在水溶液中进行,有的反应中反应物和生成物未全部给出,反应条件也未注明。
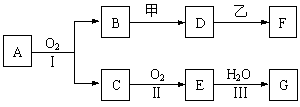
⑴若用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成;甲为一种淡黄色固体,D、F的溶液均呈碱性。则
①1.7 g A与O2反应生成气态的B和C时放出22.67 kJ热量,写出该反应的热化学方程式:___________________________________________________________________。
②B的水溶液与甲反应的离子方程式是__________________________________。
③D的水溶液和F的水溶液中由水电离出的c(OH-)___________(填字母序号)。
(a).前者大 (b).后者大 (c).一样大 (d).不知浓度,无法比较
⑵若B为红棕色固体,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则
①工业上反应Ⅰ在_______________中进行,反应Ⅲ在_______________(均填设备名称)中进行。
②由两种单质直接化合得到甲的反应条件是___________或_____________。
③D和乙反应的离子方程式是______________________________。
19.(10分)⑴常温下某无色透明溶液中所含的离子仅有NH4+和Cl-等四种离子,请回答下列问题:
①该溶液所含的离子中除上述两种外还应有_______________(填离子符号)两种离子。
②该溶液所含的上述四种离子的物质的量浓度大小有多种可能,填写下面的两种可 能:Cl->______>______>______ Cl->______>______>______
③如溶液中c(NH4+)=c(Cl-),则溶液中的溶质为_______________________(填化学式)。该溶液的pH_____7(填<、>或=)
(2)高温下,向1mol 赤热的硫化铜中通入足量的水蒸气,生成2mol 氢气,同时还生成金属铜和一种刺激性气味的气体。
①该反应的化学方程式是________________________________________________。
②该反应中氧化产物是_______________。
③每生成1 mol H2氧化剂与还原剂之间转移的电子是______________mol。
18.(12分)下图装置为模拟工业制纯碱,在饱和食盐水中通入NH3和CO2即有NaHCO3析出,若NH3气体流向自左向右,CO2气体流向自右向左,
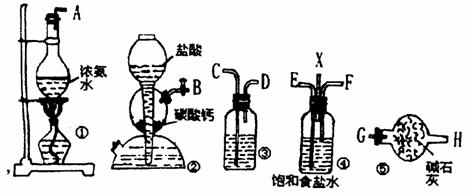
试回答: (1)各装置玻璃管接口的连接顺序为
( )接( ), ( )接( ), ( )接( ), ( )接( )。
(2)装置③装的试剂是 ,作用是 。
(3)装置④中X的作用是___________。
(4)先通NH3还是先通CO2?为什么?____________。
(5)若制得NaHCO3晶体之后欲得到纯碱,应采取的方法是___________,有关的化学方程式为_________________________________________。
17.(8分)⑴取等体积、等物质的量浓度的盐酸和乙酸溶液分别与等量(足量)相同的锌反应,通过生成H2的快慢证明乙酸是弱酸。取用“相同”的锌的目的是___________ _________________________________________________________,比较生成H2快慢的方法是___________________________________________________________。
⑵做溴乙烷水解实验时,不断振荡溴乙烷与NaOH溶液混合物的作用是___________ __________________________________,溴乙烷已完全水解的现象是_________________ ________________________________________。
16.按图装置实验,若x轴表示流入阴板的电子的物质的量,则y轴应表示?
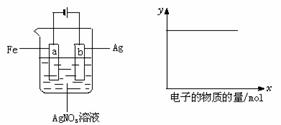
①c(Ag+) ②c(NO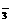 ) ③a棒的质量 ④b棒的质量
⑤溶液的pH
) ③a棒的质量 ④b棒的质量
⑤溶液的pH
A.①③ B.③④ C.①②④ D.①②⑤
第II卷(非选择题 共78分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com