
题目列表(包括答案和解析)
6.下列画有横线的物质在反应中不能完全消耗的是
A、将含少量CO2的CO气体通入盛有足量Na2O2的密闭容器中,并不断用电火花引燃
B、将1mol Mg置于10L空气中(标况),使之在高温下反应
C、将1mol Cu置于含2mol H2SO4的98%的浓硫酸中加热
D、在强光持续照射下,向过量的Ca(ClO)2悬浊液中通入少量CO2
5.下列离子方程式正确的是
A.Fe(OH)3溶于氢碘酸: Fe(OH)3+3H+=Fe3++3H2O
B.等物质的量的Ba(OH)2与KAl(SO4)2·12H2O溶液混合:
3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓
C.H218O中投入Na2O2固体: 2H218O+2O22-=4OH-+18O2↑
D.CuCl2溶液中加入NaHS溶液:Cu2++2HS-+2H2O=Cu(OH)2↓+2H2S↑
4. 实验室用一定量的铁与足量的稀硫酸及足量的CuO为原料制取单质铜,有人设计以下
实验室用一定量的铁与足量的稀硫酸及足量的CuO为原料制取单质铜,有人设计以下
两种方案:若按实验规则进行操作,则两种方法制得的单质铜的质量比较,正确的是
A.相等 B. ①多 C.②多 D.无法判断
3.通过复习总结,你认为下列对化学知识概括合理的是
A.氧化物不可能是还原产物,只可能是氧化产物
B.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
C.原子晶体、离子品体、金属晶体、分子晶体中都一定存在化学键
D.原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低
2.绿色化学己成为当前化学研究的热点和前沿,旨在从源头上消除污染,实现经济和社会可持续发展。而常温离子液体(ionic liquid)(也有称常温熔融盐)以其优异的理化特性最有可能使上述理想变为现实。1914年报道的第一种离子液体硝酸乙基铵((C2H5NH3)NO3)离子液体其熔点为12℃。已知C2H5NH2结合质子的能力比NH3略强,下列有关硝酸乙基铵的说法正确的是
A.硝酸乙基铵水溶液呈碱性
B.硝酸乙基铵水解的离子方程式可表示为:C2H5NH3++H2O=C2H5NH2+H3O+
C.相同温度下,相同物质的量浓度的硝酸乙基铵溶液和硝酸铵溶液前者的pH值小
D.离子液体可以作为电池的电解质
1.食品保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)、聚偏二氯乙烯(PVDC)等种类。PVC被广泛地用于食品、蔬菜外包装,它对人体有潜在危害。下列有关叙述不正确的是
①PVC保鲜膜属于链状聚合物,在高温时易熔化,能溶于酒精
②PVC单体可由PE的单体与氯化氢加成制得
③鉴别PE和PVC,可把其放入试管中加热,在试管口放置一湿润的蓝色石蕊试纸,如果试纸变红,则是PVC;不变红,则为PE。
④等质量的聚乙烯和乙烯燃烧消耗的氧气相等
⑤PE、PVC、PVDC单体能发生加成反应
⑥PE和PVDC属于体型高分子聚合物,高温难熔。
⑦食品保鲜膜都能发生加成反应,燃烧产物相同。
A.①②④ B. ②⑥⑦ C.③④⑤⑦ D. ②③⑥
25.(10分)以天然气、焦炭、水、空气为初始原料,可以制得若干化工产品:


(1)反应③的H2也由反应①得到。若反应①、②、③的转化率均为100%,则将反应①中得到的CO2和H2全部用于合成人工汽油。
i 通过计算说明:为什么上述方案不能得到理想的产品;
ii 若要得到理想的产品,则CO2的使用量应控制为反应①中CO2产量的______________(填倍率和倍率的范围);
(2)通过反应④、⑥合成硝酸铵。若每步反应的转化率均超过95%,则最后得到的全部产物中,N元素质量分数是多少?
(3)通过反应①、④、⑤合成尿素。若反应④中N2和H2的投料比为V(N2)∶ V(H2)=1∶3,氨合成塔中NH3的体积分数始终保持在25%,要使N2的最终转化率超过95%,则N2和H2至少需要经过 次循环。
24.(8分)金属钠和铅以物质的量之比2∶5组成的合金可以部分溶于液态氨,得到深绿色的溶液A,残留的固体是铅,溶质与残留固体的质量比为9.44∶1。溶液A可以导电,经实验证实,溶液A中除液氨原有的少量离子(NH4+离子和NH2-离子)外,只存在一种阳离子和一种阴离子(不考虑溶剂合离子),而且它们的个数比是4∶1,每个阳离子只带一个电荷。通电电解时,在阳极上析出铅,在阴极上析出钠。用可溶于液氨并在液氨中电离的盐PbI2配制的PbI2液氨溶液来滴定溶液A,达到滴定终点时,溶液A的绿色褪尽,同时溶液里的铅全部以金属铅的形式析出。[M(Pb)= 207.2 g/mol]
(1)溶液A中的电解质的化学式为 (折算为<10的整数的比);
(2)写出上述滴定反应的离子方程式并配平: ;
(3)已知用于滴定的碘化铅的浓度为0.01000 mol·L-1,达到终点时消耗碘化铅溶液20.00mL,问共析出金属铅多少克?
23.(12分)已知: ,下图是五种高分子材料的合成工艺流程之一(图中A分子中的碳原子数多于D分子中的碳原子数,J不能发生银镜反应而J有一种同分异构体能发生银镜反应):
,下图是五种高分子材料的合成工艺流程之一(图中A分子中的碳原子数多于D分子中的碳原子数,J不能发生银镜反应而J有一种同分异构体能发生银镜反应):

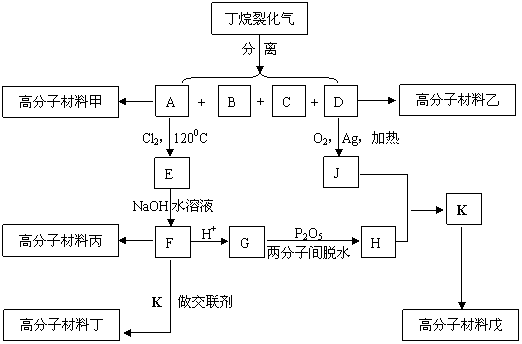

丁的结构简式为: ,1kg优质材料丁最多能吸收近800kg水。
(1)分离丁烷裂化气中各种成分的操作方法为 ;
(2)指出下列有机反应所属的反应类型:A→E属于 反应,J+H→K属于 反应;
(3)E→F的化学方程式为(有机物一律写结构简式)
;
(4)试依次分别写出丙、戊的结构简式:
、 ;
(5)在甲、乙、丙、戊四种高分子材料中 (填“甲”“乙”“丙”或“戊”中的一种或多种)不可能具有强大的吸水能力。
22.(10分)现有A、B两种有机化合物,已知:
①A、B分子含有相同数目的碳原子和氧原子,A分子侧链上一个氢原子被氨基取代后得到B;
②A、B分子氢元素的质量分数相同,相对分子质量都不超过170,A中碳元素的质量分数为72.00%;
③A、B都是一取代苯,分子中都没有甲基,都有一个羧基。
请按要求填空:
⑴A、B的分子中氢元素的质量分数都是___________;
⑵ A的结构简式是________________________;
⑶A有一同分异构体C是对位二取代苯,能发生银镜反应也能与金属钠反应,但官能团不直接与苯环相连,C的结构简式是________________________;
⑷如果B是天然蛋白质水解的最终产物,则B的结构简式为 ;
⑸B有一同分异构体D是苯环上的一硝基取代产物,其苯环和侧链上的一溴代物各有两种,D的结构简式是__________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com