
题目列表(包括答案和解析)
16.FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、、NO的物质的量之比为4﹕1﹕4时,实际参加反应的FeS与HNO3的物质的量之比为
A.2∶15 B.1∶6 C.2∶3 D.16∶25
第Ⅱ卷(共86分)
15.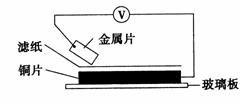 将洁净的金属片A、B、C、D分别放置在浸有NaOH溶液的滤纸上面并压紧(如图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
将洁净的金属片A、B、C、D分别放置在浸有NaOH溶液的滤纸上面并压紧(如图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
|
金属 |
电子流动方向 |
电压(V) |
|
A |
A→Cu |
+0.78 |
|
B |
Cu→B |
-0.15 |
|
C |
C→Cu |
+1.35 |
|
D |
D→Cu |
+0.30 |
已知:构成两电极的金属活泼性相差越大,电压表的读数越大。请依据表中数据判断下列说法正确的是
A.A、B、C、D的活动性都强于Cu
B.在A、B、C、D四种金属中B的还原性最强
C.在滤纸上能看到有蓝色沉淀析出的是B
D.产生蓝色沉淀的正极反应为:2Cu+4OH--4e-= 2Cu(OH)2
14.将一元酸HA的溶液与一元碱BOH的溶液等体积混合,若所得溶液呈酸性,下列有关判断正确的是
A.若混合前酸、碱物质的量浓度相同,则HA肯定是弱酸
B.若混合前酸、碱pH之和等于14,则HA肯定是弱酸
C.溶液中水的电离程度:混合溶液>纯水>BOH溶液
D.混合溶液中离子浓度一定满足:c(B+)>c(A-)>c(H+)>c(OH-)
13.工业生产苯乙烯是利用乙苯的脱氢反应:
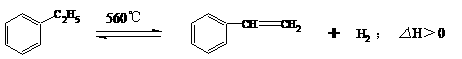
针对上述反应,有人提出如下观点,其中不合理的是
A.在保持体积一定的条件下,充入较多的乙苯,可以提高乙苯的转化率
B.在保持压强一定的条件下,充入不参加反应的气体,有利于提高苯乙烯的产率
C.在加入乙苯至达到平衡的过程中,混合气体的平均相对分子质量在不断增大
D.仅从平衡移动的角度分析,工业生产苯乙烯选择恒压条件优于恒容条件
12.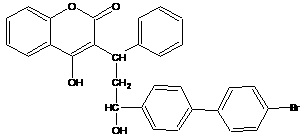 溴敌隆是一种理想的杀鼠剂,其结构简式如右图所示。溴敌隆在碱性条件下水解,再经酸化,其产物的化学式为C30H25BrO5。下列说法正确的是
溴敌隆是一种理想的杀鼠剂,其结构简式如右图所示。溴敌隆在碱性条件下水解,再经酸化,其产物的化学式为C30H25BrO5。下列说法正确的是
A.溴敌隆的化学式为C30H24BrO4
B.在碱性条件下水解时,1mol溴敌隆将消耗4molNaOH
C.溴敌隆经水解,酸化后的产物(C30H25BrO5)1mol与足量浓溴水反应,消耗Br2的物质的量为3mol
D.1mol溴敌隆最多可与12molH2发生加成反应
11.设NA为阿伏加德罗常数的值,下列说法中正确的是
A.电解精炼铜时转移0.1NA个电子时阳极溶解3.2g铜
B.1L0.1mol/L麦芽糖溶液完全水解后溶液中分子总数为0.2NA
C.标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA
D.常温下,lLpH=9的CH3COONa溶液中,由水电离的氢氧根离子数约为10-5NA个
10.下列各组离子在溶液中可以大量共存,当溶液呈强酸性时,有气体产生;而当溶液呈强碱性时,又能生成沉淀。该组离子可能是
A.Na+、Cu2+、NO3-、CO32- B.NH4+、K+、SO42-、HCO3-
C.Mg2+、NH4+、SO42-、Cl- D.Fe2+、Na+、SO42-、NO3-
9.分别配制H3PO4、KOH的乙醇溶液,取10 mL H3PO4乙醇溶液后不断振荡并滴加KOH乙醇溶液,立即产生白色沉淀,并不断增多,继而又逐渐减少至消失,然后又逐渐增多至一定量不再消失。以上事实说明
A、K2HPO4不溶于无水乙醇 B、KH2PO4、K3PO4不溶于无水乙醇
C、KH2PO4、K2HPO4不溶于无水乙醇 D、K2HPO4溶于无水乙醇
8.把NaHCO3和Na2O2的混合物放在密闭容器中加热,关于混合物加热前后消耗盐酸的量,下列说法正确的是
A.加热前后一样多 B.加热前消耗的多
C.加热后消耗的多 D.当Na2O2适量时才会一样多
7.将a g Fe2O3、Al2O3样品溶解在过量的200mL pH=1的硫酸溶液中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH溶液100 mL,则NaOH溶液的浓度为
A.0.1 mol·L-1 B.0.2mol·L-1 C.0.4 mol.L-1 D.0.8mol·L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com