
题目列表(包括答案和解析)
21、(10分)《2004年江苏省环境公报》指出:2004年全省废水排放总量为46.6亿吨,其中工业废水排放量为26.3亿吨,生活污水排放量为20.3亿吨。废水中化学需氧量(COD)排放总量为85.4万吨,其中工业废水中COD排放量为29.8万吨,占COD排放总量的34.9%;生活污水中COD排放量为55.6万吨,占COD排放总量的65.1%。氨氮排放总量为7.3万吨,石油类排放总量为1804.3吨,挥发酚排放总量为74.3吨。回答下列问题:
(1)江苏省水污染的特征是____________________________________________________。
(2)某校研究性学习小组拟选择“本地水污染情况分析”的课题进行探究。
水中的NO2-是含氮的有机物分解的产物,其浓度的大小是水源污染的标志之一。检测水中的NO2-可用比色法,其步骤是:
(I)配制标准溶液:称取0.30g NaNO2,溶于水后在容量瓶中稀释至1L得溶液A,移取5mL溶液A,稀释至1L,得溶液B。
 (II)配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具塞的平底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.3g)氨基苯磺酸(
)粉末,实验结果如下表所示。
(II)配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具塞的平底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.3g)氨基苯磺酸(
)粉末,实验结果如下表所示。
|
色阶序号 |
1 |
2 |
3 |
4 |
5 |
6 |
|
加入溶液B的体积(mL) |
0.0 |
2.0 |
4.0 |
6.0 |
8.0 |
10.0 |
|
反应后溶液颜色 |
由无色变为由浅到深的樱桃红色 |
(III)检测:取10mL水样倒入比色管中,加少许氨基苯磺酸,显色后与标准色阶对比。请填写以下空白:
A、比色法的基本依据是________________________________________________________。
B、若水样显色后与色阶中的5号颜色相同,则表明水样中含NO2-含量为_______mg/L。
C、用NaNO2直接配制溶液B的缺点是_________________________________________。
D、如果水样显色后比6号还深,应采取的措施是_________________________________。
20、(10分)A为甲、乙两种短周期元素组成的化合物,其摩尔质量为100g/mol ,甲元素的原子最外层电子数与K层电子数相等,E的水溶液显碱性,K为乙元素的单质。C为单质,其原子在周期表中半径最小。D为气体,对空气的相对密度为1.103。在适当的条件下,它们相互之间有如下图所示的转化关系。
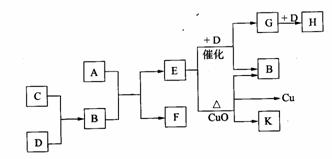
试填写下列空白:
(1)甲元素的单质在空气中燃烧除得到A外,还可得到_________。A的电子式为________。
(2)“E+D→G+B”的化学方程式为_____________________________________;
“E+CuO”的化学方程式为_________________________________________________。
(3)C和D两元素还可以形成另一种化合物I,I与一种弱酸的酸性氧化物反应生成强酸,该反应的离子方程式为__________________________________________________。
19、(8分)目前,世界上一些发达国家在积极研究太空太阳能电站问题。这种空间太阳能电站建在地球同步轨道的一个固定位置上,向地球上固定区域供电。其发电及传输示意图如图所示。在太阳能收集板上铺设太阳能电池,通过光电转换把太阳能转变成电能,再经微波转换器将电流转换成微波,并通过天线将电能以微波能形式向地面发送,地面接收站通过整流天线把微波能还原成电流。制造太阳能电池需要高纯度的硅,工业上由粗硅制取高纯度硅通过以下反应实现:
 ①Si(s)+3HCl(g)
SiHCl3(g)+H2(g);△H=-381kJ/mol
①Si(s)+3HCl(g)
SiHCl3(g)+H2(g);△H=-381kJ/mol
②SiHCl3(g)+H2(g) Si(s)+3HCl(g)
(1)元素硅在周期表中的位置位于_______________;晶体硅属于__________晶体,是_________体(导体、半导体、绝缘体);晶体硅有类似金刚石的结构,每摩尔晶体硅的共价键数目为____________,键角为________________。
(2)关于上述条件下的两个反应下列叙述不正确的是( )
A、都是置换反应 B、都是可逆反应 C、都是氧化还原反应
(3)反应②的热效应为____________反应(填“放热”或“吸热”)
18、(10分)实验室用燃烧法测定某氨基酸(CxHyNzOp)的分子组成。取mg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。按下图所示装置进行实验。
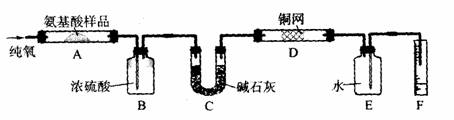
请回答下列问题:
(1)实验开始时,首先要通入一段时间的氧气,其理由是:______________________________
(2)以上装置中需要加热的仪器有__________(用字母填空,下同)。操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是_______________________________________。
(4)装置D的作用是________________________________________________________。
(5)读取N2的体积时,应注意:①_______________________________________________、②______________________________________________________________。
(6)实验中测得N2的体积V mL(标准状况)。为确定此氨基酸的化学式,还需要的有关数据是_________________________________________________。
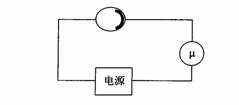
17、(11分)已知:以体积比1:1的硫酸浓度大于60%,具有一定的氧化性,浓度越大,氧化性越强,60%以下的硫酸氧化性就不怎么强。
I.某兴趣小组为研究浓硫酸(98%的浓硫酸密度为18.4g/cm3)的氧化性,设计实验装置如图。认真分析后回答:

(1)装置B用来储存多余的气体。当D处有明显的现象后,关闭活塞K,移去酒精灯,由于余热的作用,A处仍有气体产生,此时B中现象是:____________________________。
(2)同学甲先向烧瓶中放入铜片和3mL水,再从分液漏斗中加入10滴浓硫酸(约0.5mL),加热至沸腾,烧瓶中的液体是否有明显的变化,其原因是____________________________
______________________________________________________________________。甲同学再用分液漏斗加浓硫酸10mL,再加热到沸腾,现象是________________________________;
乙同学利用所示装置直接从分液漏斗中加浓硫酸10mL与铜片反应。观察到的现象与甲不同的是___________________________________________,原因是_________________________
______________________________________________________________________。
II.如用一定质量的铜片、一定体积18mol/L的浓硫酸放在烧瓶中共热后,测定剩余酸的物质的量浓度(忽略溶液体积变化),丙、丁两同学设计如下:
(3)丙先测定装置A产生SO2的量,再计算剩余酸的物质的量浓度。测定SO2的量的方法很多,其中可行的是________________
A、将装置A产生的气体通入足量硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀
B、将装置A产生的气体用排水法测定体积(已折算成标况)
C、将装置A产生的气体用排饱和NaHSO3溶液法测定体积(已折算成标况)
(4)丁将反应后的溶液稀释至1L,取20mL于锥形瓶中,滴入2滴酚酞,用标准NaOH溶液滴定,通过NaOH溶液的体积求剩余酸的浓度(已知Cu(OH)2开始沉淀的pH为5)。丁的方案能否求得余酸的物质的量浓度。简述理由。___________________________________
______________________________________________________________________________。
(5)试设计一个可行的方案,简述操作步骤及需要测定的数据。
16、在一个1L的密闭容器中,加入2mol A和1mol B,发生下述反应:
2A(g)+B(g)==3C(g)+D(s)
达到平衡时,C的浓度为1.2mol/L,维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度还是1.2mol/L的是( )
A、1mol A+0.5mol B+1.5mol C+0.1mol D
B、3mol C+0.7molD
C、2mol A+1mol B+1molD
D、0.5mol A+0.25mol B+2.25mol C
第II卷(非选择题,共86分)
15、美国研究人员在新一期网络版《科学》杂志上发表论文说,他们开发出了一种新的固体氧化物燃料电池,在用碳氢化合物--异辛烷作燃料时能源转换效率有望达到50%,电解质是用一层以氧化锆为主、含有少量钌和铈的催化重整多孔薄膜,它在高温下能传导O2-。这种新型燃料电池在经过更多试验后,能广泛应用于汽车、飞机,甚至众多家庭。下列说法正确的是( )
A、该电池的正极反应为:O2+2H2O+4e-=4OH-
B、该电池的负极反应为:C8H18+25O2――50e-=8CO2+9H2O
C、固体电解质的作用是传递电子
D、电池中阴离子向正极移动
14、改革开放以来,经济实现了快速发展,各地的城市化建设也进入了和谐的人性化发展阶段,例如建设市民广场,为市民提供夏夜纳凉的好去处。夜色中常看到小朋友手持被称为“魔棒”的荧光棒玩耍,“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式为:
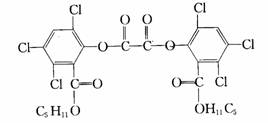
下列说法正确的是( )
A、CPPO属于芳香族化合物 B、CPPO属于高分子化合物
C、1mol CPPO与氢氧化钠稀溶液反应(苯环上卤素不水解),最多消耗4mol NaOH
D、1mol CPPO与氢气完全反应,需要氢气10mol
13、下列叙述正确的是( )
A、0.01mol/L CH3COOH与pH=12的NaOH溶液混合,若c(CH3COO-)>c(Na+),则混合液一定呈碱性
B、常温下,将等体积0.01mol/L HCl与pH=12的氨水混合,则混合液的pH=7
C、0.1mol/L的某二元弱酸盐Na2A溶液中,c(Na+)=2c(H2A)+2c(HA-)+2c(A2-)
D、将pH=3的HR与pH=11的NaOH等体积混合,已知pH≠7,则混合溶液的pH一定小于7
12、一定能在下列溶液中大量共存的离子组是( )
A、水电离产生的c(H+)=1×10-12mol/L溶液中:NH4+、Na+、Cl-、HCO3-
B、能使pH试纸变深蓝色的溶液中:Na+、AlO2-、S2-、CO32-
C、含有大量Fe3+的溶液中:Na+、I-、K+、Br-
D、澄清透明的无色溶液中:ClO-、MnO4-、Al3+、SO42-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com