
题目列表(包括答案和解析)
2.下列各组溶液,只用试管和胶头滴管,不用任何试剂便可以鉴别的是
A.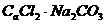 B.
B.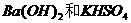
C.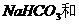 HCl D.
HCl D.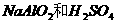
1.下列说法正确的是
A.二氧化硫的水溶液能导电,二氧化硫是电解质
B.弱电解质加水稀释,电离程度一定增大,离子浓度可能增大
C.电解质一定能导电,强电解质导电能力一定强
D.熔融的电解质一定能导电
24、相对分子质量为174的有机物M中只含有C、H、O三种元素,其分子结构如图所示。
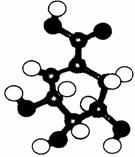 请回答下列问题:
请回答下列问题:
(1)M的结构简式是 。
(2)下列关于M的说法,正确的是
A.遇FeCl3溶液呈紫色 B.遇紫色石蕊溶液变红色
C.遇溴水发生取代反应 D.能缩聚为高分子化合物
(3)M在一定条件下发生消去反应,生成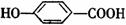 ,该反应的化学方程式是 。
,该反应的化学方程式是 。
(4)M与有机物A在一定条件下可生成一种相对分子质量为202的酯类物质。A可能的结构简式是 。
(5)研究发现,有一种物质B的分子组成和M完全一样,但分子中无环状结构;B在一定条件下水解能够产生甲醇;B的核磁共振氢谱如下图(两个峰面积比为2:3)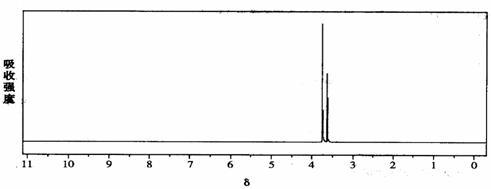
物质B的结构简式是: 。
23.完全燃烧某一类有机物,只生成CO2和H2O,消耗氧气与所生成二氧化碳的物质的量相等。
(1)此类有机物满足的通式是 。(填序号)
①(CHx)m (H2O)n ②(COx)m (H2O)n ③Cm(H2O)n
(2)此类有机物中式量最小的A是 。(填化学式)
(3)符合题示条件的物质B有多种,分子中均含有1个苯环,均含有16个原子。
①苯环上只有一个取代基,有杀菌、漂白作用的是
②不能水解,能还原银氨溶液,并能与FeC13溶液发生显色反应的物质共有 种。
22.(10分)化学几乎渗透于所有的行业,在考古工作中,化学就起着不可替代的作用。
(1)古墓中,石灰岩(主要成分CaCO3)上绘制的壁画在潮湿的条件下往往覆盖了一层白色薄膜,经测定为CaCO3,用化学反应方程式表示生成CaCO3的过程: 。
(2)古画颜料中的铅白[Pb2(OH)2CO3]由于受空气中硫化氢气体的作用而变成溶解度极小的黑色硫化铅(反应I),影响画面的色泽,当用过氧比氢处理后,可使硫化铅变成白色的物质(反应II)。椐此回答下列问题:
①铅白的物质类型是 。
②反应II中生成的白色物质的化学式为 。
③反应I的化学反应方程式是 。
(3)古代铁器(埋藏在地下)在严重缺氧的环境中,仍然锈蚀严重(电化腐蚀)。原因是一种叫做硫酸盐还原菌的细菌,能提供正极反应的催化剂,可将土壤中的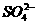 还原为S2-,该反应放出的能量供给细菌生长、繁殖之需。
还原为S2-,该反应放出的能量供给细菌生长、繁殖之需。
①写出该电化腐蚀的正极反应的电极反应式:
②文物出土前,铁器表面的腐蚀产物可能有(写化学式)
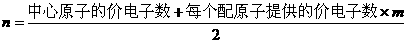
21.(10分)分子(或离子)的空间构型有直线形、角形、平面形、四面体形、三角锥形等。为了解释和预测分子的空间构型,科学家在归纳了已知分子的空间构型的基础上,提出一种简单的理论模型,其理论依据是:分子中的价电子对(包括成键电子对和孤对电子)由于相互排斥作用,而取向彼此远离以减小斥力,分子尽可能采取对称的空间构型。对于ABm形分子(A为中心原子,B为配位原子),分子中的价电子对数(n)可以通过下式确定:
|
分子构型 |
AB2 |
AB3 |
AB2 |
AB3 |
AB4 |
|
价电子对数 |
2 |
3 |
4 |
4 |
4 |
|
几何构型 |
直线形 |
平面形 |
角形 |
三角锥形 |
四面体形 |
说明:①作为配位原子,氧原子、硫原子按不提供价电子计算;
②直线形分子中最少有3个原子,平面形分子中最少有4个原子。
(1)指出下面物质分子或离子的空间构型:
PO43- CS2 A1Br3
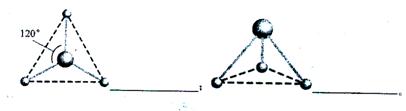 (2)有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:
(2)有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:
(3)按要求写出第二周期非金属元素构成中性分子的化学式:
平面形分子 ,三角锥形分子 ,四面体形分子 。
20.下列操作正确的是 (填字母编号)(错选扣分)
A.将未经湿润的pH试纸浸到某溶液中,过一会儿取出与标准比色卡比较,测得该溶液的PH
B.制备Fe(OH)2时,将盛NaOH(aq)的滴管伸入到试管内FeSO4(aq)的液面下
C.焰色反应操作是:将铂丝放在稀盐酸中洗涤,然后蘸取待检物置于酒精灯或煤气灯的火焰上灼烧,观察火焰的颜色
D.中和滴定中,锥形瓶用蒸馏水洗净后直接往其中注入一定量的待测溶液
E.各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量
F. 配制0.1mol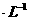 的H2SO4溶液时,将量取的浓H2SO4在烧杯中用蒸馏水稀释后立即移入容量瓶
的H2SO4溶液时,将量取的浓H2SO4在烧杯中用蒸馏水稀释后立即移入容量瓶
G.用渗析法除去淀粉中混有的NaCl杂质
H.检验红砖中的氧化铁成分时,向红砖粉末中加入盐酸,密闭放置至充分沉淀后,取上层清液于试管中,滴加KSCN溶液2滴~3滴即可
19.现有100mL溶质为MgC12和A1C13的混合溶液,其中c(C1-)=1.0mol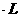
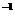 ,c(MG2+)=0.2mol
,c(MG2+)=0.2mol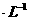 。若不考虑水解因素,则要使其中的Mg2+全部转化Mg(OH)2沉淀而分离出来,至少需要4mol
。若不考虑水解因素,则要使其中的Mg2+全部转化Mg(OH)2沉淀而分离出来,至少需要4mol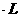 -1的NaOH溶液的体积是
-1的NaOH溶液的体积是
A.25mL B.5mL C.30mL D.100mL
姓名 学号
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18.将羧酸的碱金属盐电解可生成烃类化合物,例如:
2CH3COOK+2H2O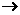 CH3CH3+2CO2
CH3CH3+2CO2 +H2
+H2 +2KOH。现充分电解C1CH2-COONa的水溶液,并加热电解后的水溶液,则下列说法中合理的是
+2KOH。现充分电解C1CH2-COONa的水溶液,并加热电解后的水溶液,则下列说法中合理的是
A.电解时阴阳两极都有气体产生 B.混合液蒸干后得到的固体物质是NaOH
C.加热后有不溶于水的油状物生成 D.电解时阴阳两极气体积比略小于1:2
17. 常温时某无色溶液白水电离出c(H+)=amol/L ,c(OH-)=bmol/L, 且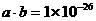 ,该溶液中可能大量共存的离子是
,该溶液中可能大量共存的离子是
①Zn2+、C1-、Ba2+、NO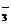 ②Na+、NO
②Na+、NO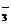 、K+、
、K+、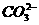
③K+、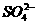 、Na+、
、Na+、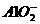 ④
④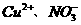 、A13+、SO
、A13+、SO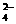
A.只有①④ B.只有②③ C.①②③ D.都不可能①②③④.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com