
题目列表(包括答案和解析)
20.(9分)某校化学小组学生进行“气体相对分子质量的测定”的实验。操作如下:用质量和容积都相等的烧瓶收集气体,称量收集满气体的烧瓶质量。数据见下表(已换算成标准状况下的数值)。
|
气体 |
A |
B |
C |
D |
E |
F |
|
烧瓶和气体的总质量(g) |
48.56 |
48.56 |
48.56 |
48.52 |
48.60 |
49.28 |
已知标准状况下,烧瓶的容积为0.448 L,烧瓶和空气的总质量是48.58 g。空气的平均相对分子质量为29。A、B、C、D、E、F是中学常见的气体。
(1)上述六种气体中,能够使品红溶液褪色的是(写化学式) 。
(2)E的相对分子质量是 。
(3)实验室制取少量D的化学方程式是 。
(4)A、B、C可能的化学式是 。
19.一定量的锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6L(标准状况)。将反应后的溶液稀释至1 L,测得溶液的pH=1,则下列叙述中错误的是
A.气体A为SO2和H2的混合物 B.气体A中SO2与H2的体积之比为4:1
C.反应中共消耗97.5g Zn D.反应中共转移3 mol电子
第Ⅱ卷 (非选择题 共83分)
18.对于平衡体系mA(g)+nB(g) 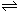 pC(g)+qD(g);△H<0。下列结论中正确的是
pC(g)+qD(g);△H<0。下列结论中正确的是
A.若平衡时A、B的转化率之比为m:n,说明反应开始时,A、B的物质的量相等
B.若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.48倍,则m+n>p+q
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入b mol B,达到新平衡时,气体的总物质的量等于(a+b)mol
D.若升高温度时,平衡混合气体的平均相对分子质量增大,则m+n>p+q
17.常温下,有甲、乙两份体积均为1 L,浓度均为0.1 mol·L-1的氨水,其pH为11。
①甲用蒸馏水稀释100倍后,溶液的pH将为a;②乙与等体积、浓度为0.2mol·L-1的HCl混合,在混合溶液中:n(NH4+)+n(H+)-n(OH-)=b mol 。a、b正确的答案组合是
A.9-11之间;0.1 B.9-11之间;0.2
C.12-13之间;0.2 D.13;0.1
16.把铝粉与下列氮的气态氧化物混合后,加热至高温,均可生成氮气和氧化铝。若反应后气体对容器的压强是反应前气体对容器压强的1/2(恒温恒容条件下测得),则氮的氧化物可能是
A.NO B.N2O3 C.NO2 D.N2O5
15.2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效 的烯烃复分解催化剂。工业上冶炼钼的化学原理为
①2MoS2+7O2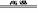 2MoO3+4SO2,②MoO3+2NH3·H2O==(NH4)2MoO4+H2O,
2MoO3+4SO2,②MoO3+2NH3·H2O==(NH4)2MoO4+H2O,
③(NH4)2MoO4+2HCl==H2MoO4↓+2NH4Cl,④H2MoO4==MoO3+H2O,
⑤用还原剂将MoO3还原成金属钼。
则下列说法中正确的是
A.MoS2煅烧产生的尾气不可直接排到空气中
B.MoO3是金属氧化物,也是碱性氧化物
C.H2MoO4是一种强酸
D.利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3:3:2
14.某化学学习性研究小组为确定一化工废液的成分,进行了如下实验操作:向少量样品废液中加入过量盐酸时有白色沉淀生成。过滤后,向滤液中加入过量氨水使溶液呈碱性时,有白色沉淀生成。过滤后,向滤液中加入小苏打溶液,又有白色沉淀生成。则该废液中可能含有的离子是
A.Ag+、Ca2+、Mg2+ B.AlO2-、Ba2+、Mg2+
C.Mg2+、Ag+、Na+ D.Ag+、Na+、Ba2+
13.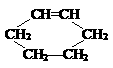 亚碳化合物的特征是在1个碳原子上有2个未成对电子,亚碳化合物是具有很高反应活性的有机化合物。下列物质可能属于亚碳化合物的是
亚碳化合物的特征是在1个碳原子上有2个未成对电子,亚碳化合物是具有很高反应活性的有机化合物。下列物质可能属于亚碳化合物的是
A.CH3 B.H2C5(线状) C. D.H-C≡C-H
12.已知1.2g C(石墨)不完全燃烧生成CO,放出11.1kJ热量,继续燃烧又放出28.3kJ热量。则能表示C(石墨)燃烧热的热化学方程式为
A.C(石墨)+1/2O2(g)==CO(g);△H=-11.1 kJ·mol-1
B.C(石墨)+1/2O2(g)==CO(g);△H=-111 kJ·mol-1
C.C(石墨)+O2(g)==CO2(g);△H=-394 kJ·mol-1
D.C(石墨)+O2(g)==CO2(g);△H=-283 kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com