
题目列表(包括答案和解析)
17.(8分)KMnO4溶液常用做氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1h;(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处;(4)利用氧化还原滴定方法,在700C-800C条件下用基准试剂(纯度高、式量较大、稳定性较好的物质)溶液标定其浓度。请回答下列问题:
(1)不用普通滤纸过滤器过滤KMnO4溶液的原因是___________________________________;
(2)如何保证在700C-800C条件下进行滴定操作:______________________________;
(3)准确量取一定体积的KMnO4溶液用________________;
(4)在下列物质中,用于标定KMnO4溶液的基准试剂最好选用___________(填序号);
A.H2C2O4•2H2O B.FeSO4 C.浓盐酸 D.Na2SO3
(5)若准确称取Wg你选的基准试剂溶于水配成500mL水溶液,取25.00mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液VmL。问:
①滴定终点标志是____________________;
②KMnO4溶液的物质的量浓度为_______________mol/L;
(6)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量,测得的浓度值将________(填“偏高”或“偏低”)
16.500mL KNO3和Cu(N03)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是 ( )
A.原混合溶液中c(K+)为2 mol·L-1 B.上述电解过程中共转移4 mol电子
C.电解得到的Cu的物质的量为0.5 mol D.电解后溶液中c(H+)为2 mol·L-1
第Ⅱ卷 (非选择题 共86分)
15. 将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
14.含有ag硝酸的稀溶液跟bg铁恰好反应,铁全部溶解,生成NO,已知有a/4克硝酸被还原,则a:b可能是
①3:1 ②3:2 ③4:1 ④9:2
A.① B. ④ C. ①③④ D. ①④
13.将一定体积的某NaOH溶液分成两等份,一份用pH=3的一元酸HA溶液中和,消耗酸溶液的体积为V1;另一份用pH=3的一元酸HB溶液中和,消耗酸溶液体积为V2,则下列叙述正确的是
A.若V1>V2,则说明HA的酸性比HB的酸性强
B.若V1>V2,则说明HA的酸性比HB的酸性弱
C.因为两种酸溶液的pH相等,故V1一定等于V2
D.若将两种酸溶液等体积混合,混合溶液的pH一定等于2
12.下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述正确的是
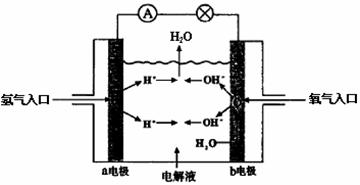
A.a电极是负极
B.b电极的电极反应为:4OH--4e-=2H2O+O2
C.电池工作时,电子由正极通过外电路流向负极
D.氢氧燃料电池是一种具有应用前景的绿色电源
11.0.1mol/LKHSO4和0.1mol/LNa2S溶液等体积混合后,溶液能使pH试纸变蓝,则离子浓度关系正确的是
A.c(SO42-) >c (HS-)>c (OH-) >c (H+)
B.c (Na+) > c(K+) > c (H+)> c (OH-)
C.c (Na+) =c (S2-)+c (H2S)+c (HS-)+c(SO42-)
D.c (Na+)+c(K+)+c (H+)=c(SO42-)+c (S2-)+c (HS-)+c (OH-)
10.NA为阿伏加德罗常数,下列说法正确的是
A.处于非标准状况下的22.4L氧气中所含有的氧分子数一定不是NA
B.26.75个NH4Cl中含有的共用电子对数为2NA
C.将5.0mol/L的FeCl3溶液20mL滴加到沸水中形成的胶体中,分散质粒子数为0.1NA
D.1L水中所含的H+数目为10-7×NA
9.下列反应的离子方程式书写错误的是
A.氨水中通入少量二氧化硫 2NH3•H2O + SO2 = 2NH4+ +SO32- +H2O
B.3mol的Cl2通入含2molFeI2的溶液中: 2Fe2++4I-+3Cl2=2Fe3++6Cl-+2I2
C.次氯酸钙溶液中通入过量二氧化碳 Ca2+ +2ClO- +CO2 +H2O = CaCO3 ↓+ 2HClO
D.A、NaHSO3溶液显酸性是因为:HSO3-==SO32-+H+
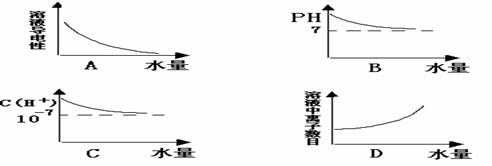
8、常温下,将水滴入一定体积的0.1 mol/L的氨水中,下列图象中不合理的是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com