
题目列表(包括答案和解析)
21.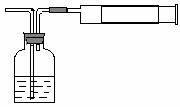 (1)小陈同学为测定新装修居室内甲醛含量是否超标,设
计了如右图的简易实验装置。请你帮助小陈同学选择试剂瓶内的药品________
(1)小陈同学为测定新装修居室内甲醛含量是否超标,设
计了如右图的简易实验装置。请你帮助小陈同学选择试剂瓶内的药品________
a、银氨溶液 b、酸性高锰酸钾溶液
c、新制氢氧化铜悬浊液
(2)合成氨工业中,原料气(N2、H2、少量CO的混合物)
在进入合成塔前常用醋酸二氨合铜溶液来吸收原料气中的CO,其反应是:
[Cu(NH3)2Ac]+ CO + NH3  [Cu(NH3)3]Ac·CO;△H<0
[Cu(NH3)3]Ac·CO;△H<0
①必须除去原料气中CO的原因是_____________________________________
②吸收CO后溶液经过适当处理又可再生,恢复其吸收CO的能力,以供循环使用,醋酸铜氨溶液再生的生产适宜条件应是___________________________
(3)通常人们把拆开1 mol化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
已知:Cl2(g)+3F2(g)=2ClF3(g);△H=-309.3kJ·mol-1
2F(g)=F2(g);△H=-157.7kJ·mol-1
2Cl(g)=Cl2(g);△H=-237.8kJ·mol-1
则ClF3分子中Cl-F化学键的键能为________________kJ·mol-1
20.(10分)已知A为中学化学中的常见金属,X、Y为常见非金属,X、E、F、G、J常温下为气体,C为无色液体,B是一种盐,受热易分解。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图(部分反应的条件、生成物被略去):

请回答下列问题:
(1)金属A为___________;操作a是_______________________________________
(2)反应⑤的化学方程式为_____________________________________________
反应⑦的化学方程式为_____________________________________________
(3)原电池反应①中,正极反应式为_____________________________________
19. (8分)A、B、C、D、E、G、F均为短周期元素,且原子序数依次增大,A与D同主族,C与G同主族,A与B的质子数之和等于C的质子数,A+与C2-的核外电子数之和等于D+的核外电子数,B原子与D+的核外电子数之和等于F原子的核外电子数,E原子比B原子多8个电子。请回答下列问题:
(8分)A、B、C、D、E、G、F均为短周期元素,且原子序数依次增大,A与D同主族,C与G同主族,A与B的质子数之和等于C的质子数,A+与C2-的核外电子数之和等于D+的核外电子数,B原子与D+的核外电子数之和等于F原子的核外电子数,E原子比B原子多8个电子。请回答下列问题:
(1)比较D与G、A与E形成的两组化合物的熔点高低(用化学式和“>” 或“<”表示)_________________________________
(2)B的单质的电子式为__________________________
(3)E和C可形成如右图所示的化合物,该物质的化学式为 ______________
(4)A、B、C、F中的三种元素可形成多种化合物,其中既含有离子键,又含有共价键,且水溶液呈酸性的的化合物也不止一种,请用离子方程式表示其呈酸性的原因:
18.(12分)大约有85%的化学反应需要用催化剂,催化剂研究是十二一世纪化学研究的重要课题之一。
(1)现行高中化学课本第一册162页学生实验一中设计了CuO对KClO3分解的催化作用的实验,某化学兴趣小组对此产生了兴趣,研究CuO和MnO2对KClO3分解的催化性能。
实验装置:

实验记录:
|
实验序号 |
试管中药品 |
加热时间 |
待测数据 |
|
1 |
8gKClO3
+2gMnO2 |
20s |
|
|
2 |
8gKClO3+2gCuO |
20s |
|
问题与讨论
①这里的待测数据是____________________________
②测气体的体积,是选装置(Ⅰ)还是选装置(Ⅱ)? ________________
③实验开始时,是先把导管通入量筒中,还是先加热?理由是什么?
____________________________________________________________________
④实验时间到后,应如何操作?
____________________________________________________________________
(2)已知下列反应:2H2O2+2KMnO4+3H2SO4=K2SO4+MnSO4+5O2↑+8H2O。学生在做此实验时发现:在敞口容器中,当H2O2与酸化的KMnO4溶液混合后,开始产生氧气的速率很慢,一段时间后产生氧气的速率很迅速,经测定溶液的温度基本没变,该学生经过思考认为不可能是温度、浓度、压强的影响,只可能是催化剂的影响。为了证实自己的推断,设计了以下对比实验:
①空白实验; ②起始时加入少量K2SO4固体;
③起始时加少量______________ ④起始加入少量水
实验结果:起始反应速率③最快,④最慢,①②基本相同
请解释实验①过程中现象产生的原因____________________________________。
17.(11分)某学生做元素性质递变实验时自己设计了一套方案,并记录了有关实验现象如下表
|
实验方案 |
实验现象 |
|
1.用砂纸打磨后的镁带与水反应,再向反应后溶液中滴加酚酞 |
(A) |
|
2.向新制的氢硫酸饱和溶液中滴加新制的氯水 |
(B)产生气体,可在空气中燃烧,溶液变成浅红色 |
|
3.钠与滴有酚酞的试液的冷水反应 |
(C)反应不十分强烈,产生的气体可在空气中燃烧 |
|
4.镁带与2mol/L的盐酸反应 |
(D)剧烈反应,产生可燃性气体 |
|
5.铝条与2mol/L的盐酸反应 |
(E)生成白色胶状沉淀,然后沉淀消失 |
|
6.向氯化铝溶液中滴加氢氧化钠溶液至过量 |
(F)生成黄色沉淀 |
请你帮助该同学完成实验报告:
(1)实验的目的 。
(2)实验仪器:① ② ③ ④试管夹⑤镊子⑥小刀⑦玻璃片⑧砂纸等
(3)实验内容:
与实验方案1-6对应的实验现象依次为 (填:字母编号)。
实验现象(A)为: 。
16.将22.4g铁粉缓缓加入到含有HNO3 0.8mol的稀硝酸中(还原产物为NO),下列正确的是
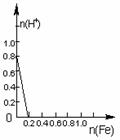
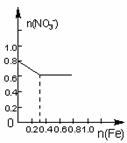
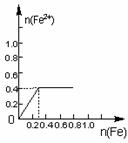
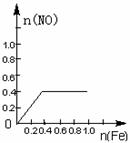
A B C D
15.常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通CO2 气体,只能生成HX和NaHCO3;往NaY溶液中通入CO2则生成HY和Na2CO3。有关叙述正确的是
A.酸性由强至弱:H2CO3>HY> HX
B.结合H+的能力:Y―> X―> CO32―
C.溶液物质的量浓度相同时碱性:NaY >Na2CO3> NaX >NaHCO3
D.NaX溶液中通入足量CO2后的离子浓度:c(X―)>c(Na+)>c(HCO3―)>c(OH―)
14.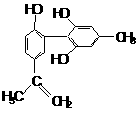 坚决反对运动员服用兴奋剂,是我国支持“人文奥运”的重要体现。某种兴奋剂的结构简式如右图所示,有关该物质及其溶液的说法不正确的是
坚决反对运动员服用兴奋剂,是我国支持“人文奥运”的重要体现。某种兴奋剂的结构简式如右图所示,有关该物质及其溶液的说法不正确的是
A.该分子中不可能所有氢原子在同一个平面上
B.1 mol该物质与浓溴水反应时,最多消耗3 molBr2
C.加入FeCl3溶液呈紫色,因为该物质属于酚类物质
D.滴入酸性高锰酸钾溶液,紫色褪去,可证明结构中存在碳碳双键
13.下表中,对陈述I、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是
|
选项 |
陈述I |
陈述Ⅱ |
判断 |
|
A |
工业上SO2氧化成SO3用常压 |
SO2氧化成SO3是气体体积缩小的反应 |
I对;Ⅱ对;有 |
|
B |
SO2可用于漂白纸浆 |
SO2中硫呈+4价有氧化性 |
I对;Ⅱ对;无 |
|
C |
金属钠具有强还原性 |
高压钠灯发出透雾性强的光 |
I对;Ⅱ对;有 |
|
D |
石墨常用作电解池的电极 |
石墨的化学性质稳定且导电性好 |
I对;Ⅱ对;有 |
12.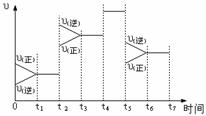 下图表示反应
下图表示反应 ,在某一时间段中反应速率与反应过程的关系图。下列说法正确是
,在某一时间段中反应速率与反应过程的关系图。下列说法正确是
A.t1-t2 SO3的百分含量最高
B.t2时可能是增大了压强
C. t5时可能是升高了温度
D. t3-t5一直处于平衡,正逆反应速率没有改变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com