
题目列表(包括答案和解析)
22.(10分)相对分子质量为94.5的有机物A,在一定条件下可以发生如下图所示的转化(其他产物和水已略去);
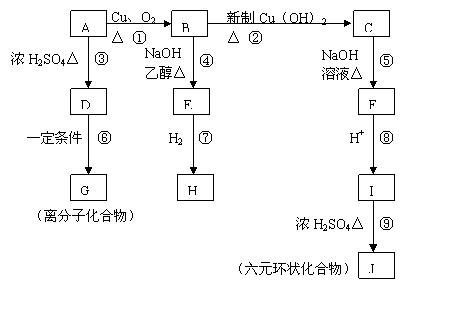
请回答下列问题:
(1)写出下列物质的结构简式:A ,J 。
(2)上述①-⑨的反应中, 是消去反应(填编号)。
(3)写出B→C的化学反应方程式:
。
(4)有机物I在一定条件下可合成一种环保高分子材料,则该高分子结构简式为
21.(10分)金属镁和镁合金在航空、汽车制造和电子工业等领域具有广泛的用途,金属镁的冶炼有多种方法,其中之一为皮江法。该方法是以白云石(CaCO3•MgCO3为原料,经高温煅烧生成氧化物(CaO•MgO),氧化物在还原炉中经1200℃真空条件下用硅铁还原生成镁蒸汽(铁在反应前后化合价不变),镁蒸汽经冷凝器冷聚为粗镁,粗镁再经精炼、铸锭得到成品金属镁。反应工艺流程如下图:
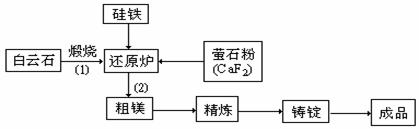
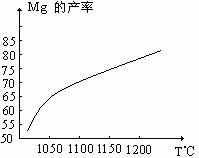 ⑴在冶炼过程中反应温度对生成金属镁的影响如图,从图中分析,还原反应的反应热
⑴在冶炼过程中反应温度对生成金属镁的影响如图,从图中分析,还原反应的反应热
△H 0(填“<”“>”“=”)理由是 。
⑵还原炉中需要在1200℃真空条件下反应,反应达到平衡时的温度与压强的关系如下
|
剩余压强mmHg |
760 |
10 |
1 |
0.1 |
|
平衡时的温度℃ |
2370 |
1700 |
1430 |
1235 |
真空条件对制备金属镁来讲,可以达到的目的是:
① ②
⑶含镁矿物常见的有菱镁矿(MgCO3)、白云石和光卤石(KCl••MgCl2• 6H2O),其中
KCl••MgCl2• 6H2O属于 。A.纯净物 B.混合物 C.配合物
⑷写出下列反应的方程式
①煅烧白云石 。②CaO•MgO与Si的反应 。
20. (10 分) 已知:A、B 是两种盐的溶液,其焰色反应均呈黄色,A 呈中性,B呈碱性并具有氧化性;D 在CCl4中呈紫红色。下图为相关实验步骤和实验现象
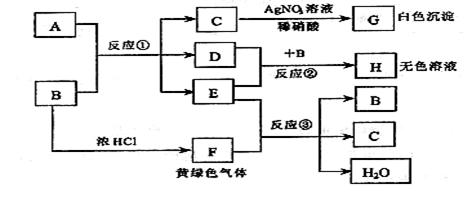
请回答:
(1) 依次写出 A、B 中溶质的化学式:A_______ B________
(2) 依次写出反应①和②的离子方程式(H 中含有某+5价元素含氧酸根离子)
______________________________ ; ___________________________
(3) 写出反应③的化学方程式___________________________________
19. ( 9 分)由新型无机非金属材料制成的无水冷发动机,热效率高、寿命长。
这类材料中研究较多的是化合物G。
(1)化合物G 的相对分子质量为140,G 中含硅元素,其质量分数为60%,另有元素Y。
G 可以由化合物E(含两种元素)与NH3反应而生成,同时产生HCl 气体。
请推断:G 和E的化学式分别为______________、______________。
(2)粉末状G 能够与氧气反应,所得产物中有一种是空气中的主要成分,另一种是工业
上生产玻璃的主要原料。请写出化合物G 与氧气反应的化学方程式
(3)常压下在G 中添加氧化铝,经高温烧结可制成一种高强度、超硬废、耐磨损、抗腐蚀的陶瓷材料,它的商品名叫“赛伦”,化学通式可表示为Si6-XAlXOXY8-X。在接近1700℃时x的极限值约为4.0,在1400℃时 x为2.0,以保持整个化合物呈电中性。推测:
赛伦中以下元素的化合价:Si_______Y______,塞伦的晶体类型__________
18.(12分)一氯甲烷,也叫甲基氯,常温下是无色气体,密度为0.9159克/厘米3,熔点为-97.73℃,沸点为-24.2℃,18℃时在水中的溶解度为280毫升/毫升水,与乙醚、丙酮或苯互溶,能溶于乙醇。在实验室里可用下图装置制造一氯甲烷:
 制备装置的分液漏斗和烧瓶中分别盛有甲醇和浓盐酸。
试填写下列空白:
(1)制备一氯甲烷的化学方程式____________________________________________
制备装置的分液漏斗和烧瓶中分别盛有甲醇和浓盐酸。
试填写下列空白:
(1)制备一氯甲烷的化学方程式____________________________________________
(2)检验气体产物CH3Cl的方法是:____________________________________________
CH3Cl燃烧的化学方程式是____________________________________________
(3)实验中实际按甲醇和浓盐酸1:2(物质的量之比)进行反应的理由是
____________________________________________
(4)某学生在关闭活塞x的情况下做此实验时发现,收集到一定体积的气体产物所消耗的甲醇-浓盐酸的混和液的量比正常情况下多(装置的气密性没有问题),其原因是
____________________________________________
(5)实验结束后,d中收集到的液体中含有__________________________________________
17.(11分)
⑴下列仪器中:①漏斗 ②容量瓶 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥滴定管 ⑦燃烧匙,常用于物质分离的是 (填编号)。
⑵某同学为验证苯的沸点(80.1℃)比水低,以试管取用少量的苯放在水浴中,并在水浴中插一温度计。实验开始后,用酒精灯给水浴加热。
该实验有一个明显的缺点是什么?
应如何改进?
⑶为了从含有 FeCl3、FeC12、CuC12 的废液中回收Cu,某研究性学习小组的同学们设计了两种方案:
方案1 :向废液中加入过量的铁粉,充分反应后,过滤。 在所得滤渣中加入足量的盐酸,
充分反后,再过滤即得到铜。方案1中涉及的四种阳离子的氧化牲由强到弱的顺序
为:______________________________________
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的Cu已全部析出。
方案2中铜作______极,所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出)_______________________________________________________
方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,
主要表现为: ____________________________________________________
16.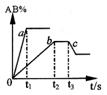 右图是反应A2
+B2
右图是反应A2
+B2 2AB 在不同温度和压强下,AB体积
2AB 在不同温度和压强下,AB体积
分数(AB%)的变化情况,其中a、b 曲线为相同压强、不同温
度时的变化情况,c 曲线在保持与b 相同温度时从时间t3 开
始增大压强的情况,则下列叙述正确的是
A.A2 、B2 、AB 均为气体,正反应放热
B.AB 为气体,A2 、B2 中最少有一种为非气体,正反应放热
C. AB 为气体,A2 、B2 中只有一种为非气体,正反应吸热
D.从时间t3开始到重新达到平衡这段时间内,体系内的气体平均摩尔质量一定发生变化。
15.下列反应的离子方程式正确的是
A. 在碳酸氢镁溶液中加入足量 Ca(OH)2 溶液:
Mg2+ +2HCO3-+Ca2+ +2OH-=MgCO3↓ + CaCO3↓ + 2H2O
B.电解饱和食盐水: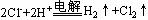
C.过量的铁与浓硝酸反应: Fe+6H++3NO3- = Fe3+ 十3NO2↑+3H2O
D.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加足量Ba(OH)2溶液
NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3•H2O+2H2O
14. 根据以下实验的检验所得出的结论可靠的是
A.常温下测定发现,等物质的量浓度H2CO3的pH大于H2SO3的pH,所以碳元素比硫元素的非金属性弱
B. 向无色溶液通入Cl2 后,溶液变为黄色,加入淀粉溶液后溶液变蓝,说明原溶液中有I-
C.向淀粉溶液中加入稀硫酸加热,后取出少量加入一定的新制的氢氧化铜浊液,加热至沸腾,无砖红色沉淀产生,由此确定淀粉还未水解。
D. 向无色溶液加BaCl2溶液,生成白色沉淀,再加稀硝酸,沉淀不消失,由此确定该溶液中一定含有SO42-
13. 下列关于反应能量的说法正确的是
A.Zn(s) +CuSO4 (aq) =ZnSO4 (aq) +Cu(s) ; △H =-216kJ·mol-1 ,
反应物总能量>生成物总能量
B.相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子的能量为E2。则2E1>E2
C.l0lkPa 时,2H2 (g)+ O2 (g) =2H2O(1);△H =-571. 6 kJ·mol-1 ,
H2的燃烧热为571.6 kJ·mol'
D.H+ (aq) +OH-(aq) =H2O(l) ;△H=-57.3 kJ·mol-' ,含 1molNaOH 的氢氧化钠
溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com