
题目列表(包括答案和解析)
16.一基态原子的第四电子层只有2个电子,则该原子的第三电子层电子数可能为
A.8 B.12 C.17 D.18
15.要配制浓度约为2 mol/L NaOH溶液100mL,下面的操作中正确的是
A.称取8g NaOH固体,放入250 mL烧杯中,用100 mL量筒量取100 mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B.称取8 g NaOH固体,放入100 mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后,用蒸馏水稀释至100 mL
C.称取8 g NaOH固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水至刻度,盖好瓶塞,反复摇匀
D.用100 mL量筒量取40 mL 5 mol/L NaOH溶液,倒入250 mL烧杯中,再用同一量筒量取60 mL蒸馏水,不断搅拌下,慢慢倒入烧杯中
14.下列有关水的叙述中,可以用氢键的知识来解释的是
A.水比硫化氢气体稳定 B.水的熔沸点比硫化氢的高
C.0℃时,水的密度比冰的大 D.氯化氢气体易溶于水
13.X和Y均为原子序数大于4的短周元素,Xn+和Ym-两种离子的核外电子排布相同,下列说法中正确的是
A.X的原子半径比Y小 B.X和Y的核电荷数之差为m-n
C.电负性X<Y D.元素的第一电离能X<Y
12.600℃时,在一密闭容器中,将二氧化硫和氧气混合发生反应:2SO2(g)+O2(g)
 2SO3(g);△H<0。反应过程中SO2、O2、SO3物质的量变化如图,下列说法不正确的是
2SO3(g);△H<0。反应过程中SO2、O2、SO3物质的量变化如图,下列说法不正确的是
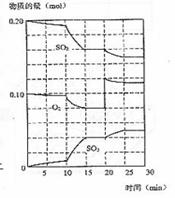 A.反应从0 min开始,到第一次平衡时,二氧化硫的转
A.反应从0 min开始,到第一次平衡时,二氧化硫的转
化率为40%
B.反应进行到10min至15min的曲线变化可能升高了温度
C.反应进行至20min时,曲线发生变化是因为通入了氧气
D.在15-20min;25-30min内时反应处于平衡状态
11.草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.1 mol/L KHC2O4溶液中,下列关系不正确的是
A.c(K+) + c(H+) = c(HC2O4-) + c(OH-) + c(C2O42-)
B.c(HC2O4-) + c(C2O42-) = 0.1 mol/L
C.c(HC2O4-) > c(C2O42-)
D.c(K+) = c(HC2O4-) + c(H2C2O4) + c(C2O42-)
10.设NA为阿伏加德罗常数,下列叙述正确的是
A.1mol FeCl3完全转化为Fe(OH)3胶体后生成NA个胶粒
B.在MnO2的作用下,1molH2O2充分反应转移2NA个电子
C.在标准状况下,22.4L H2和4g He均含有NA个分子
D.50℃1×105Pa下,46gNO2与0℃2×105Pa下46gN2O4均含有3NA个电子
9.我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如下图所示,有关该物质的说法正确的是
A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
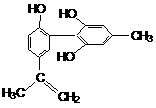 B.滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键
B.滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键
C.1 mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4 mol、7 mol
D.该分子中的所有碳原子有可能共平面
8.为了除去NO、NO2、N2O4对大气的污染,常采用NaOH溶液进行吸收处理(反应方程式为:NO2 + NO + 2NaOH == 2NaNO2 + H2O;3NO2 + 2NaOH == 2NaNO3 + NO + H2O)。现有由a mol NO、b mol NO2、c mol N2O4组成的混合气体恰好被V L氢氧化钠溶液所吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度最小为
A.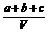 mol/L
B.
mol/L
B. mol/L C.
mol/L C.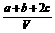 mol/L D.
mol/L D.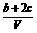 mol/L
mol/L
7.在一容积可变的密闭容器中,通入1mol X和3 mol Y,在一定条件下发生如下反应:
X (g) + 3 Y (g) 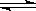 2 Z (g),到达平衡后, Y的转化率为a
%, 然后再向容器中通入2 mol Z,保持在恒温恒压下反应,当达到新的平衡时,Y的转化率为b
%。 则a与b的关系是
2 Z (g),到达平衡后, Y的转化率为a
%, 然后再向容器中通入2 mol Z,保持在恒温恒压下反应,当达到新的平衡时,Y的转化率为b
%。 则a与b的关系是
A. a = b B.a > b C.a < b D. 不能确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com