
题目列表(包括答案和解析)
26.已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性。现有浓度均为0.1 mol·L-1的NaHSO3溶液和NaHCO3两种溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中一定正确的是
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+) +c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.两种溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
25.由铝屑与盐酸、氢氧化钠溶液反应制取1 mol Al(OH)3,最少需要消耗HCl和NaOH的物质的量为
A.3 mol、3 mol B.1 mol、1 mol
C.0.75 mol、0.75 mol D.0.25 mol、0.25 mol
24.下列离子方程式书写正确的是
A.氢氟酸与石灰水反应:H+ + OH- == H2O
B.制备氢氧化铁胶体:Fe3+
+ 3H2O 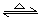 Fe(OH)3(胶体)+ 3H+
Fe(OH)3(胶体)+ 3H+
C.相同物质的量浓度相同体积的FeBr2溶液和氯水混合:
2Fe2+ + 2Br- + 2Cl2 == 2Fe3+ + Br2 + 4Cl-
D.少量NaHCO3溶液和足量Ba(OH)2溶液混合:
Ba2+ + 2OH- + 2HCO3- == BaCO3↓+ CO32- + 2H2O
23.当向蓝色的CuSO4溶液中逐滴加入氨水时,观察到首先生成蓝色沉淀,而后沉淀又逐渐溶解成为深蓝色的溶液,向深蓝色溶液中通入SO2气体又生成了白色沉淀:将白色沉淀加入稀硫酸中,又生成了红色粉末状固体和SO2气体,同时溶液呈蓝色,根据上述实验现象分析推测,下列描述正确的是
A、Cu2+ 和Ag+ 相似,能与NH3结合生成铜氨络离子
B、白色沉淀为+2价铜的某种亚硫酸盐,溶于H2SO4发生复分解反应
C、白色沉淀为+1价铜的某种亚硫酸盐,溶于H2SO4发生自身氧化还原反应
D、反应过程中消耗的SO2与生成的SO2物质的量相等
22.从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。下列说法不正确的是
A、此法的优点之一是原料来源丰富
B、第④步电解时阴极产生氯气
C、①②③步骤的目的是从海水中提取MgCl2固体
D、①②步骤中涉及化合、分解和复分解反应
21.一定温度下,在恒容密闭容器中发生如下反应:2A(g)
+ B(g) 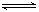 3C(g),若反应开始时充入2molA和2molB,达到平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
3C(g),若反应开始时充入2molA和2molB,达到平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
A、2molC B、2molA 、1molB和1molHe(不参加反应)
C、1molB和1molC D、2molA 、3molB和3molC
20.25℃时,相同的物质的量浓度的下列溶液中,水的电离程度排列顺序正确的是
①NaHCO3 ②NaOH ③H2SO4 ④Na2CO3
A、①>④>②>③ B、②>③>①>④
C、④>①>②>③ D、④>②>①=③
19.已知反应:2SO2 +O2 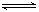 2SO3 ;△H<0,在恒温下的密闭容器中加入2molSO2和1molO2,达到平衡后,SO2的转化率为a,而在隔热密闭的同一容器中加入一样多的SO2和O2,到达平衡后,SO2的转化率为b,若反应前两容器温度相同,则a与b的正确关系为
2SO3 ;△H<0,在恒温下的密闭容器中加入2molSO2和1molO2,达到平衡后,SO2的转化率为a,而在隔热密闭的同一容器中加入一样多的SO2和O2,到达平衡后,SO2的转化率为b,若反应前两容器温度相同,则a与b的正确关系为
A、 a<b B、 a>b C、a=b D、无法判断
18.由氧化铜和氧化铁组成的混合物a g,加入2 mol·L-1的硫酸溶液50 mL,恰好完全溶解,若将a g的该混合物在过量的CO气流中加热充分反应,冷却后剩余固体的质量为
A.1.6a g B.(a-1.6) g C.(a-3.2) g D.无法计算
17.X、Y、Z为短周期元素,这些元素原子的最外层电子数分别是1、4、6,则由这三种元素组成的化合物的化学式不可能是
A.XYZ B.X2YZ C.X2YZ2 D.X2YZ3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com