
题目列表(包括答案和解析)
24.(8分)有机物A为食品包装纸的常用防腐剂。A碳链无支链,可以使溴水褪色,难溶于水,但在酸性条件下可以发生水解反应,生成二元不饱和有机酸B和饱和一元醇C。一定量的C完全燃烧,生成的水物质的量是二氧化碳的两倍。B、C的混合物,只要总物质的量一定,不管以何种比例混合,完全燃烧生成的水物质的量也一定。B是符合上述条件相对分子质量最小的分子。
(1)B分子所含官能团的名称是 。
(2)C的分子式为 。
(3)由B制取A的化学方程式是 。
(4)高分子化合物M可由有机物B在一定条件下反应制得,其各元素质量分数与B完 全相同,则高分子化合物M的结构简式是 。
23.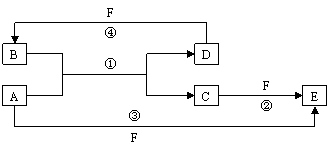 (11分)A、B、C、D、E、F六种物质的转化关系如下图所示(反应条件和部分产物未标出)。
(11分)A、B、C、D、E、F六种物质的转化关系如下图所示(反应条件和部分产物未标出)。
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为 ,反应④的化学方程式为:
(F为浓溶液) 。
(2)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是 。已知常温下1 g D与F反应生成B(气态)时放出92.3kJ热量,写出该反应的热化学方程式:
。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为 。
22.(10分)以下是周期表中短周期元素的有关数据x,x表示元素原子获得电子的能力。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0.98 |
1.57 |
|
|
|
|
|
|
|
2.04 |
a 2.55 |
b |
c 3.44 |
d 3.98 |
|
|
e 0.93 |
1.48 |
|
|
|
|
|
|
|
f 1.61 |
1.90 |
2.19 |
g 2.58 |
h 3.16 |
|
(1)x越大,表示该元素原子越 (填“难”或“易”)形成阴离子。
(2)一般来讲,两元素的x值差(△x)大于1.7时,形成离子键;小于1.7时,形成共价键,则f、c组成的化合物属 化合物。
(3)能否用电解f、h化合物的水溶液制取f, (填“能”或“否”),用电解化学方程式表示为 。
(4)a-h中两种元素组成的化合物或单质,在某隔热的密闭容器中反应示意图如下。
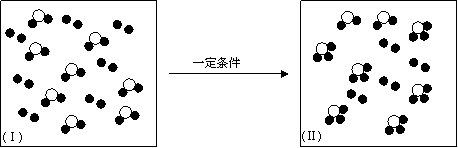 I表示反应前的分子状况,Ⅱ表示容器温度不再升高的分子状态,●和○分别表示不同的原子。
I表示反应前的分子状况,Ⅱ表示容器温度不再升高的分子状态,●和○分别表示不同的原子。
该反应的化学方程式为(不必注明反应条件) 。
21.(15分) (1)背景:2003年抗“非典”、2005年抗“禽流感”中,“过氧乙酸”是广泛用于医院、禽舍等方面的消毒液。“过氧乙酸”的消毒液成分和消毒原理引起了某化学兴趣小组的关注。
(2)查询资料:
资料一:H2O2是极弱的电解质,在酸性介质中才能稳定存在,是一种强氧化剂;
CH3COOH是弱酸,也能使蛋白质变性,是一种消毒液。
资料二:过氧乙酸消毒液是由H2O2、H2O、CH3COOH及少量H2SO4混合后,反应生成过氧乙酸(CH3COOOH),反应的化学方程式为CH3COOH+H2O2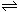 CH3COOOH+H2O。CH3COOOH容易放出原子氧,它与空气中微生物机体作用,达到灭菌目的,是消毒液的主要成分。
CH3COOOH+H2O。CH3COOOH容易放出原子氧,它与空气中微生物机体作用,达到灭菌目的,是消毒液的主要成分。
(3)实验研究:兴趣小组找到过氧乙酸商品,下面是市售过氧乙酸的商品、标签。
|
过氧乙酸 本品包括甲、乙两种溶液,体积各500mL,把甲、乙溶液各1份 在玻璃容器中混合后,放置24h后,产生过氧乙酸浓度不少于10%, 应用50倍纯水稀释(浓度为0.2%),稀释后才能使用。 |
研究过程:
①提出假设:略。
②实验探究:取甲、乙两种溶液少许,分别用干燥的蓝色石蕊试纸检验,前者的现象为先变红后褪色,后者的现象为变红后不褪色。
③得出结论:。
甲溶液的主要成分为 。
乙溶液的主要成分为 。
④有效成分含量测定:某同学设计了测定的方案(不需详细的操作过程)。
用已知浓度的NaOH溶液滴定乙,测定其中的有效成分含量。
(a)用酚酞作指示剂。
(b)用到的玻璃仪器除了玻璃棒、量筒、胶头滴管外还缺 。
(c)滴定前仰视、滴定后俯视则测到的有效成分含量 (选填“偏高”、“偏低”或“不变”)。
(d)请简要说出测定另一有效成分的方法(不需详细的操作过程):
。
(4)请你为本实验拟一研究报告题目: 。
20.(9分)(1)下列有关实验的操作方法或现象有误的是 。

(2)Fe(OH)3胶体外观与Fe(SCN)3溶液相似,请设计一种简单的方法将它们鉴别出来且不破坏它们: 。
(3)如何检验Fe(OH)3胶体中是否混有Fe3+,简述实验方法: 。
19. 已知NaHSO3溶液和Na2CO3溶液混合后加热煮沸能产生CO2气体。现有浓度均为0.1
mol·L-1的NaHSO3溶液和NaHCO3溶液,则两溶液中各粒子物质的量浓度的关系一定正确的是(R表示S或C)
已知NaHSO3溶液和Na2CO3溶液混合后加热煮沸能产生CO2气体。现有浓度均为0.1
mol·L-1的NaHSO3溶液和NaHCO3溶液,则两溶液中各粒子物质的量浓度的关系一定正确的是(R表示S或C)
A.c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
B.c(H+)+c(H2RO3) = c(RO32-)+c(OH-)
C.c(Na+)>c(HRO3-)>c(H+)>c(OH-)>c(RO32-)
D.c(HRO3-)>c(H2RO3)>c(OH-)>c(RO32-)>c(H+)
第Ⅱ卷 (非选择题 共83分)
18.向含1mol HCl和1mol MgSO4的混合溶液中加入1mol·L-1的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是
17.在373K时,密闭容器中充入一定物质的量的NO2和SO2,发生如下反应:NO2+SO2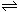 NO+SO3,平衡时,下列叙述中正确的是
NO+SO3,平衡时,下列叙述中正确的是
A.NO和SO3的物质的量一定相等
B.NO2和SO2的物质的量一定相等
C.体系中总的物质的量一定等于反应开始时总的物质的量
D.SO2、NO2、NO、SO3的物质的量一定相等
16.按下图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液 体,则X气体可能是
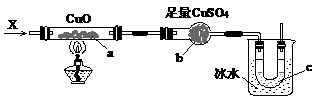
A.H2 B.CO和H2 C.NH3 D.CH3CH2OH(g)
15.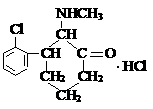 “K”粉,在医学上称氯胺酮,是一种白色粉末,属于静脉全麻药品,具有一定的精神依赖性。目前,该药物已被我国药检部门列为第二类精神药品管理。其结构简式如右图,则下列说法中正确的是
“K”粉,在医学上称氯胺酮,是一种白色粉末,属于静脉全麻药品,具有一定的精神依赖性。目前,该药物已被我国药检部门列为第二类精神药品管理。其结构简式如右图,则下列说法中正确的是
A.“K”粉的化学式为C13H18NOCl2
B.“K”粉能与NaOH溶液发生反应
C.1 mol“K”粉在一定条件下可与4 mol H2发生加成反应
D.“K”粉分子中最多有7个C原子处于同一平面
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com