
题目列表(包括答案和解析)
86.在一定条件下利用电解的方法可以将含有少量的Fe、Zn、Cu、Pt等金属杂质的粗镍提纯。下列叙述正确的是(已知氧化性:Fe2+<Ni2+<Cu2+)
A.纯镍作阴极
B.阳极发生还原反应
C.粗镍连接电源的正极,其电极反应为:Ni2+ + 2e- = Ni
D.电解后,电解槽底部有含Cu和Pt等金属杂质的阳极泥
85.等物质的量的X(g)与Y(g)在密闭容器进行可逆反应:X(g)+Y(g)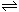 2Z(g)+W(s);△H<0,下列叙述正确的是
2Z(g)+W(s);△H<0,下列叙述正确的是
A.平衡常数K值越大,X的转化率越大
B.达到平衡时,反应速率v正(X)=2v逆(Z)
C.达到平衡后,降低温度,正向反应速率减小的倍数小于逆向反应速率减小的倍数
D.达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
84.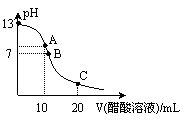 25℃时,向20mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,其pH变化曲线如图所示,有关粒子浓度的比较中,正确的是
25℃时,向20mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,其pH变化曲线如图所示,有关粒子浓度的比较中,正确的是
A.在A点:c(Na+)>c(OH-)>c(CH3COO-) >c(H+)
B.在A点:c(Na+)+ c(H+)= c(OH-)+c(CH3COO-)
C.在B点:c(CH3COO-)>c(Na+)>c(H+)=c(OH-)
D.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
83.下列说法正确的是
A.苯酚、乙酸、氢氧化钾三种溶液可用FeCl3溶液一次鉴别
B.CH3CH2OH、CH3OH、CH3CHO三种溶液可用新制Cu(OH)2一次鉴别
C.CaCl2溶液中混有少量FeCl3,可加入过量的CaCO3,再过滤
D.KCl溶液中混有少量KI,可通入足量Cl2后,再用乙醇进行萃取、分液
82.在一个体积为1L的密闭容器中,充入2 mol A和1mol B,发生如下反应:2A(g) +B(g) 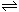 xC(g),平衡后,C的体积分数为w%,若维持容器容积和温度不变,以0.6mol A、0.3mol B和1.4mol C为起始物质,达到平衡后,C的体积分数也为w%。平衡后若缩小容器体积,C的浓度c(C)、C的体积分数C%、混合气体平均相对分子质量
xC(g),平衡后,C的体积分数为w%,若维持容器容积和温度不变,以0.6mol A、0.3mol B和1.4mol C为起始物质,达到平衡后,C的体积分数也为w%。平衡后若缩小容器体积,C的浓度c(C)、C的体积分数C%、混合气体平均相对分子质量 和正反应速率v(正),随压强p的变化曲线,一定符合的是
和正反应速率v(正),随压强p的变化曲线,一定符合的是
 A
B
C
D
A
B
C
D
81.已知HF的电离常数Ka = 3.6×10-4;CaF2的溶度积常数Ksp =1.46×10-10,向1L 0.1 mol·L-1 HF溶液中,加入11.1g CaCl2(常温下,CaCl2的溶解度大于2g)。下列说法正确的是
A.HF是弱酸,电离方程式为HF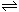 H+
+ F-
H+
+ F-
B.通过计算得知HF与CaCl2不反应
C.通过计算得知,HF与CaCl2可以反应产生沉淀
D.HF是强酸,CaF2易溶于水
80. 右图是某硫酸试剂瓶的标签上的部分文字。据此,下列说法正确的是:
右图是某硫酸试剂瓶的标签上的部分文字。据此,下列说法正确的是:
A、该试剂应保存在玻璃试剂瓶中,并用橡胶塞塞紧
B、1mol Zn与足量的该硫酸反应生成2g H2
C、该硫酸与等体积水混合所得溶液的物质的量浓度为9.2mol·L-1
D、向50 mL该硫酸溶液中加入足量的铜片,加热充分反应后,被还原的硫酸的物质的量小于0.46mol
79.现有下列短周期元素的数据
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径 |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
0.82 |
|
最高化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
最低化合价 |
-2 |
|
|
-3 |
-1 |
|
-3 |
|
下列说法中,正确的是:
A、元素原子序数④大于⑦ B、②、③号元素处于同一周期
C、⑤号元素最高价氧化物的水化物酸性最强 D、⑧号元素是金属元素
78.常温离子液体(又称常温熔融盐),是当前化学研究的热点和前沿。1914年报道第一种离子液体硝酸乙基铵[(C2H5NH3)NO3]的熔点为12℃。已知C2H5NH2的化学性质与NH3相似,下列有关硝酸乙基铵的说法中,正确的是:
A、该离子液体可以作为电池的电解质
B、硝酸乙基铵水溶液呈碱性
C、(C2H5NH3)NO3能与NaOH反应产生NH3
D、硝酸乙基铵水解的离子方程式可表示为C2H5NH3+ + H2O == C2H5NH2 + H3O+
77. A、B、C分别是中学常见的单质。D、E、F常见的三种氧化物,其中E为有毒气体,且有如图所示转化关系。下列说法中,不正确的是:
A、B、C分别是中学常见的单质。D、E、F常见的三种氧化物,其中E为有毒气体,且有如图所示转化关系。下列说法中,不正确的是:
A、若A是非金属,则B一定为金属
B、单质B肯定是氧化剂
C、A、B、C中一定有一种氧元素的单质
D、D、E中一定都含有A元素
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com