
题目列表(包括答案和解析)
96.往含0.2mol KOH和0.1mol Ca(OH)2的溶液中持续稳定地通入CO2气体,当通入气体的体积为6.72L(标准状况)时立即停止,则在这一过程中,溶液中离子的物质的量n和通入CO2的体积V的关系示意图正确的是(气体的溶解忽略不计)

95.下列叙述正确的是
A.浓度均为0.1mol/L的NH4Cl溶液与NaOH溶液的混合液中,可能存在:
c(Na+) = c(Cl-) > c(OH-) > c(H+)
B.仅含有Na+、H+、OH-、CH3COO-四种离子的某溶液中,可能存在:
c(Na+) > c(OH-) > c(CH3COO-) > c(H+)
C.pH = 12的氨水与pH = 2的盐酸等体积混合后,混合液中:
c(Cl-) > c(NH4+) > c(H+) > c(OH-)
D.浓度均为0.1mol/L的小苏打溶液与烧碱溶液等体积混后,混合液中:
c(Na+) + c(H+) = c(CO32-) + c(OH-) + c(HCO3-)
94.分别在pH=1的酸溶液和pH=13的NaOH溶液中加入足量的铝,产生氢气的体积相同,下列说法正确的是
A.若两溶液的体积相同,则酸是弱酸
B.若两溶液的体积相同,则酸是多元强酸
C.若酸是强酸,则酸的浓度等于NaOH的浓度
D.若酸是强酸,则酸溶液的体积比NaOH溶液体积大
93.如图A、B是等容积的真空容器,K是开关,活塞可以左右移动。在一定温度下,关闭K,向A中通入一定量的NO2,发生反应:2NO2(g) 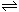 N2O4(g);△H<0。同以下说法正确的是
N2O4(g);△H<0。同以下说法正确的是

A.打开K,稍后关闭它,再向右推动活塞到虚线处,最后A中的气体颜色比B中的浅
B.打开K,稍后关闭它,再加热B容器,B中的气体颜色比A中的浅
C.保持活塞位置不变,打开K,A中的气体颜色变浅
D.打开K,稍后关闭它,再向B中通入氩气,B中的气体颜色比A中的深
92.在一固定体积的密闭容器中,有下列化学反应:CO(g)+H2O(g)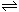 CO2(g)+H2(g),其化学平衡常数K和温度的关系如下表:
CO2(g)+H2(g),其化学平衡常数K和温度的关系如下表:
|
T(℃) |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
则下列有关的叙述正确的是
A.该反应正向反应为放热反应
B.在温度升高平衡移动过程中气体压强始终保持不变
C.若绝热时(容器内外没有热量交换),平衡移动的结果使二氧化碳的浓度增大,则容器内气体的温度一定降低
D.若在某平衡状态时,c(CO2)×c(H2) = c(CO)×c(H2O),则此时的温度为830℃
91.NaCl溶液中可能混有杂质NaOH、NaHCO3、Na2CO3中的一种或两种,为测定溶液中混有的杂质成分,可进行如下实验操作:分别取两份等体积混合液,用0.10mol·L-1的标准盐酸溶液滴定,以酚酞或甲基橙为指示剂,达到终点时消耗盐酸的体积分别为V1和V2,且V2>2V1>0。则NaCl溶液中混有的杂质可能为
A.NaOH B.Na2CO3 C.Na2CO3、NaHCO3 D.NaOH、Na2CO3
90.对氨水溶液中存在的电离平衡:NH3·H2O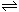 NH4+
+ OH-,下列叙述正确的是
NH4+
+ OH-,下列叙述正确的是
A.加水后,溶液中n(OH-)增大
B.加入少量浓盐酸,溶液中c(OH-)增大
C.加入少量浓NaOH溶液,电离平衡向正反应方向移动
D.加入少量NH4Cl固体,溶液中c(NH4+)减少
89.下列实验能达到预期目的的是
①用蒸馏的方法可将海水淡化;②将混合气体通过盛有品红溶液的洗气瓶,可除去CO2中的SO2 ;③向溶液中滴入盐酸酸化的氯化钡溶液可检验溶液中是否含有SO42- ;④向含有Mg(OH)2和Ca(OH)2的浊液中加入足量MgCl2溶液,充分反应后过滤,可除去Ca(OH)2
A.①② B.①④ C.②③ D.③④
88.下列叙述正确的是
A.同周期元素的原子半径以ⅦA族的为最大
B.同主族两种元素原子的核外电子数的差值可能为26
C.短周期中次外层电子数是最外层电子数2倍的原子一定是非金属元素
D.科学家在周期表中金属与非金属分界线处找到了优良的催化剂
87.关于非金属元素N、C、Si的叙述中正确的是
A.它们都能以游离态存在于自然界
B.它们的氧化物都能与强碱反应生成含氧酸盐
C.气态氢化物的稳定性为CH4>SiH4
D.N2和C在一定条件下分别与足量的O2反应,其△H都大于零
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com