
题目列表(包括答案和解析)
26.(10分)
(1)化学反应的实质是“旧键的断裂,新键的形成”。在一定条件下,从一个乙醇分子中断键去掉两个氢原子可生成多种新的有机物。请尽可能多地写出这些有机物的结构简式。
(2)在将铜导线进行焊接时,往往要先除去导线表面上的氧化物锈斑。若是将导线烧热后在酒精里蘸一下,导线的表面就会变得既红又亮。写出有关反应的化学方程式。
(3)下列是一些制取物质的设想,请指出其中违背科学原理的一项,并简单说明错误的原因。
(A)用玉米、植物秸杆等作原料制造乙醇,用作汽车的燃料
(B)用动物的骨或皮作原料制造滋补品
(C)用淀粉作原料提取淀粉酶,用作催化剂
(D)用植物油或动物脂肪作原料制造甘油
25.(10分)
(1)恒温下密闭容器中的可逆反应:xA(g)+yB(g) zC(g)达到化学平衡时增加C的物质的量,一段时间后重新达到平衡,测得各物质的体积分数仍保持不变。若此反应的化学平衡常数K值为4,x、y为整数,z为2,A、B的起始浓度均为1mol/L,则C的平衡浓度为
mol/L。
zC(g)达到化学平衡时增加C的物质的量,一段时间后重新达到平衡,测得各物质的体积分数仍保持不变。若此反应的化学平衡常数K值为4,x、y为整数,z为2,A、B的起始浓度均为1mol/L,则C的平衡浓度为
mol/L。
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g)  CO2(g)十H2 (g) △H<0
CO2(g)十H2 (g) △H<0
CO和H2O浓度变化如下图,则 0-4min的平均反应速率v(CO)=______ mol/(L·min)
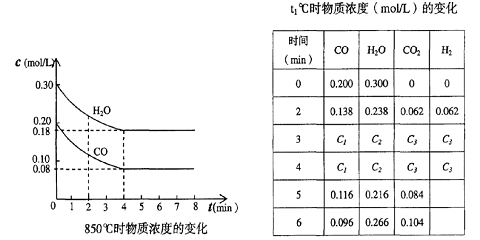
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min-4min之间反应处于_________状态; C1数值_______0.08 mol/L (填大于、小于或等于)。
②反应在4min-5min之间,平衡向逆方向移动,可能的原因是_____(单选),表中5min-6min之间数值发生变化,可能的原因是_______(单选)。
(A)增加水蒸气 (B)降低温度
(C)使用催化剂 (D)增加氢气浓度
24.
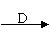 (10分)A、D为短周期元素的单质,B、C为化合物,C遇水能产生无色气体。一定条件下它们之间的转化关系如下图所示:
(10分)A、D为短周期元素的单质,B、C为化合物,C遇水能产生无色气体。一定条件下它们之间的转化关系如下图所示:
A B C
(1)试判断下列两种情况下A、B、C、D的化学式。
C遇水所得溶液不能使酚酞试液变红:A B C D
C遇水所得溶液能使酚酞试液变红:A B C D
(2)写出两种情况下的C分别与水反应的化学方程式
23.(14分)现有一份Fe2O3与CuO的混合物,欲用CO还原法测定其中Fe2O3的质量分数ω(Fe2O3)。制取CO可用乙二酸晶体在浓硫酸作用下加热生成CO、CO2,然后用纯净的CO还原混合物。实验中测定以下数据:反应前混合物的质量m1;反应后混合物的质量m2。
可供选择的实验用品有:18mol/LH2SO4溶液、6mol/LBa(OH)2溶液、蒸馏水、乙二酸晶体、NaOH溶液、CaCO3、NaCl、Fe2O3与CuO的混合物,常用仪器等





 (1)请设计并绘制一个实验装置示意图(假定每步反应和杂质吸收均是完全的)。各仪器分别用下列代号表示(玻璃管口之间的联结胶管不必画出):敞口玻璃容器 ;有塞玻璃容器 或 ;普通漏斗 ;分液漏斗 ;酒精灯 ;玻璃导管 或 ;并用A、B、C……依次给各仪器标号。
(1)请设计并绘制一个实验装置示意图(假定每步反应和杂质吸收均是完全的)。各仪器分别用下列代号表示(玻璃管口之间的联结胶管不必画出):敞口玻璃容器 ;有塞玻璃容器 或 ;普通漏斗 ;分液漏斗 ;酒精灯 ;玻璃导管 或 ;并用A、B、C……依次给各仪器标号。
(2)请写出示意图上用A、B、C……标示的各容器中盛放的物质的名称:
A B C D E ……
(3)请用m1和m2表示求ω(Fe2O3)的计算式:ω(Fe2O3) =
22.(8分)分别将等质量的铜片与等体积且均过量的浓硝酸、稀硝酸反应,所得溶液前者呈绿色,后者呈蓝色,有同学提出溶液呈绿色是铜与浓硝酸反应时产生的二氧化氮溶于过量的浓硝酸,其产生的黄色与蓝色的硝酸铜溶液混在一起,使溶液呈绿色。
为了验证该同学的推断是否正确,甲、乙、丙三位同学各设计了一个实验方案。
甲同学的方案:将盛绿色溶液的试管加热,看是否有红棕色的气体产生。
(1)你认为甲同学的方案的不妥之处是什么?应该作怎样的修正(实验装置及方法不变)?
乙同学的方案:用双氧水和二氧化锰制得氧气,并把氧气通入绿色溶液中,观察其溶液是否变蓝色。
(2)请用化学方程式表示其中的化学反应原理。
丙同学的方案:在通风橱内,将一根下端弯成螺旋状且可抽动的铜丝插入盛有足量浓硝酸的试管A中,立即可观察到试管中充满红棕色的NO2气体。将NO2气体经导管通入到倾斜的另一支装有淡蓝色Cu(NO3)2溶液的试管B中,随着实验进行,试管B中的溶液蓝色加深,很快又转变为绿色,继续通入NO2,绿色保持不变,向上抽起铜丝,使反应停止。
(3)简述丙同学的方案中的溶液变色的原因。
(4)从环保的角度看,你认为三个方案中最好的是哪一个?说明理由。
21.(10分)
(1)一般所谓“无水”乙醇,含乙醇约99.5%,还有约0.5%的水。当特殊需要而要求进一步除去水时,常采用如下操作:置5g镁条和0.5g碘(碘作催化剂)于一恰当容量的烧瓶中,倾入50~75mL“无水”乙醇,逐渐加热,此时有小气泡不断从混合液中逸出,继续加热回流直至镁条完全溶完,成为乳白色浆液。再倾入900mL“无水”乙醇,回流30min,然后直接蒸出乙醇,这样得到的乙醇其含量可以达到99.95%。试回答:
上述操作应选取的烧瓶的容积为 (选填序号)
(A)2L (B)1L (C)0.5L (D)0.2L
做出以上选择的理由是:
(2)亚硝酸钠可用作水泥施工的抗冻剂。它易溶于水,有咸味,既有氧化性,也有还原性。在酸性溶液中它能氧化碘离子、亚铁离子。亚硝酸钠和酸反应生成亚硝酸,亚硝酸是不稳定且比醋酸的酸性还要弱的弱酸,亚硝酸只能存在于冷的稀溶液中,在浓溶液中或受热时易发生如下的分解反应:3HNO2 = 2NO↑+HNO3+H2O
从浓醋酸、氨水、纯碱、稀盐酸、碘化钾淀粉溶液中选择适当的物质做试剂,用两种简单的化学实验鉴别亚硝酸钠和氯化钠。试写出两种实验方法所使用的试剂和据以鉴别它们的现象。
方法一(只用一种试剂):
方法二:
20.可用下列示意图像表示的是
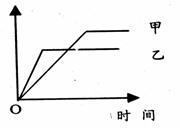
|
|
反应 |
纵坐标 |
甲 |
乙 |
|
A |
等质量的钠、钾分别与足量乙醇反应 |
H2质量 |
钠 |
钾 |
|
B |
在同一容器中一定质量的氨气分解 |
氨气的 转化率 |
500℃ |
400℃ |
|
C |
体积比1∶3的N2、H2在体积可变的恒压容器中合成氨 |
氨气的 浓度 |
活性高的催化剂 |
活性一般的催化剂 |
|
D |
2molSO2与lmolO2在相同温度下化合 |
SO3物 质的量 |
10个 大气压 |
2个大气压 |
第Ⅱ卷(非选择题,共80分)
19.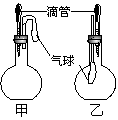 如图所示的甲、乙两个装置中,胶头滴管
如图所示的甲、乙两个装置中,胶头滴管
中吸入某种液体,平底烧瓶中充入(或放入)另一种
物质,挤压胶头滴管加入液体,一段时间后两装置
中的气球都有明显的胀大(忽略液体体积对气球的影
响)。则所用试剂可能分别依次是
(A)甲:浓硫酸和木炭 乙:浓氨水和HBr
(B)甲:双氧水和MnO2 乙:NaOH溶液和NO2
(C)甲:苯酚和Na2CO3溶液 乙:NaOH溶液和Cl2
(D)甲:浓硫酸和蔗糖(滴有几滴水) 乙:水和氨气
18.欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32¯)、c(HCO3¯)都减小,其方法是
(A)通入过量二氧化硫气体 (B)加入少量水稀释
(C)通入氯化氢气体 (D)加入饱和石灰水溶液
17.下列反应中,氧化剂与还原剂物质的量的关系为2∶1的是
(A)2H2S+SO2 = 3S↓+2H2O (B)2Na+O2 = Na2O2
(C)Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O
(D)2CH3COOH+Ca(ClO)2 = 2HClO+Ca(CH3COO)2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com