
题目列表(包括答案和解析)
1.C 2.B 3.A 4.D 5.D 6.C 7.B 8.D 9.A
7.在某澄清、透明的浅黄色溶液中,可能含有K+、NH4+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、Cl-离子。进行下述实验(所加试剂均过量)。

(1)气体A的化学式是 ,沉淀A的化学式是 ;
(2)检验溶液中是否含有K+的操作是
;
(3)待测液中一定存在 ;
(4)待测液中一定不存在 ;其原因是
;
(5)写出溶液C与过量氨水反应的离子方程式
。海淀高三化学补漏题参考答案
6.某校学生小组进行硫酸铜晶体里结晶水含量的测定实验,其实验步骤如下:
①用坩埚准确称取2.0 g硫酸铜晶体,记下坩埚和硫酸铜晶体的总质量m1;
②将盛有硫酸铜晶体的坩埚放在三角架上面的泥三角上,缓慢加热,直到蓝色的硫酸铜晶体完全变成白色,且不再有水蒸气逸出,然后将坩埚冷却;
③待坩埚冷却后,将坩埚放在天平上称量,记下坩埚和无水硫酸铜的总质量m2。
(1)②中加热硫酸铜晶体时所用的仪器有 。
(2)上述每一步实验中,都有一个很关键的步骤没有给出,它们是① ;② ;③ 。
(3)写出硫酸铜晶体(CuSO4·xH2O)中结晶水的表达式x= 。
(4)该小组最终测定的结果偏高,其原因可能是(选填字母序号) 。
A.取出的硫酸铜晶体未研成粉末,就开始加热
B.在①中称量坩埚和硫酸铜晶体时,天平指针偏右
C.加热时,硫酸铜晶体刚变为白色,就停止加热
D.将加热后的白色粉末放在空气中冷却
5.菠菜中有含铁元素的物质和乙二酸。乙二酸俗称草酸,易溶于水。其主要物理常数如下:
|
名称 |
分子式 |
颜色、状态 |
溶解性(g) |
熔点(℃) |
密度 (g/cm3) |
|
乙二酸 |
H2C2O4 |
无色 |
8.6(20℃) |
189.5 |
1.900 |
|
二水合乙二酸 |
H2C2O4·2H2O |
无色晶体 |
-- |
101.5 |
1.650 |
某化学小组同学为了研究草酸(乙二酸的结构HOOC-COOH)的化学性质,进行以下实验。
(1)该小组同学向盛有5mL乙二酸饱和溶液的试管中滴入3滴硫酸酸化的0.5%(质量分数)的KMnO4溶液,振荡,观察到现象为 ;由此可推知乙二酸具有 (填“氧化性”或“还原性”);菠菜中铁元素的主要存在价态可能是 ;
(2)已知草酸分解的化学方程式为H2C2O4 H2O+CO2↑+CO↑。该小组同学为了验证草酸受热分解的产物,设计了如图所示装置的实验。

 |
|||||||
|
|||||||
|
|||||||
|
|||||||
实验前,有同学提出用草酸晶体进行实验,遭到大家的反对,其原因是
;
有同学提出这个实验不能检验二氧化碳气体,还需在B、C之间加入4个D装置,依次加入的试剂是 、
和浓硫酸,其中第3个D装置的作用是 。
4.某校化学小组同学设计以下装置,进行不同的实验。其中a为用于鼓入空气的气囊, b为铜丝螺旋,c为喷有少量碱液的棉花,d中盛有冰水。


(1)若选用A装置做乙醛与新制氢氧化铜反应的性质实验,需去掉的仪器是 。制备新制氢氧化铜的正确操作是在试管里加入10%的 (填写化学式)溶液2 mL,滴入2%的 (填写化学式)溶液4~6滴,振荡。乙醛与新制氢氧化铜反应的化学方程式为
。
(2)若用A装置做乙醇与乙酸酯化反应的实验,则还需连接的仪器是(填序号) ,该仪器中应加入的试剂是 。要加快酯化反应的速率,采用的措施是 。写出含18O的乙醇与乙酸反应的化学方程式
。
(3)该小组同学欲做浓硫酸与铜反应的实验,并检验产生的二氧化硫。他们应选用的装置是 ,用于检验产物二氧化硫可选用的试剂是 ,在所选装置中(填序号) 部分是为了减少二氧化硫对空气的污染。
(4)该小组同学欲做乙醇氧化成乙醛的实验,他们可选用的装置是 。用制得的乙醛溶液再进行银镜反应,正确的操作顺序是(按先后顺序填写序号) 。
①向试管中滴入3滴乙醛溶液
②一边振荡一边滴入2%的稀氨水,至最初产生的沉淀恰好溶解为止
③振荡后放入热水中,水浴加热
④在洁净的试管里加入1 mL 2%的AgNO3溶液
写出该银镜反应的化学方程式
。
(5)该小组同学欲用A装置做铜与浓硝酸反应的实验,请你判断该实验是否可行
(填“是”或“否”),其原因是 。
3.A、B、D、E、F、G为短周期元素,且原子序数依次递增。A、F同主族,E、G同主族。A与其它非金属元素化合时易形成共价键,F与其它非金属元素化合时易形成离子键,且F+离子与E2-离子核外电子排布相同。由以上元素组成的物质BE和D2具有相同的电子数。请回答以下问题:
(1)F位于 周期, 族;
(2)G的离子结构示意图 ;
(3)用电子式表示D2的形成过程 ;
(4)由A、E、F三种元素形成的化合物的化学式为 ,含有的化学键有 (填写完整化学键类型),属于 晶体;
(5)B的最高价是 ,由A、B组成的化合物中,含A量最高的物质的化学
式是 ,含B量最高的物质的化学式是 (写出两种)。与D2式量相等的物质的化学式是 ,含有的化学键有 (填写完整化学键类型),属于 晶体,有 对共用电子对。
2.(1)实验测得1 mol H2与1 mol Cl2反应生成2 mol HCl时,放出184.6 kJ的热量,其理论分析数据与实验数据略有差异,下图表示上述反应能量变化的理论分析示意图:
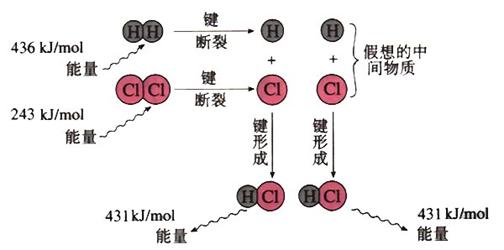
①化学键断裂需要 (填“释放”或“吸收”)能量;
②图中共释放的能量 kJ/mol;
③该反应的反应物的总能量 (填“大于”、“等于”或“小于”)反应产物的能量,所以该反应是 反应;
④用图示数据计算其反应热,写出该反应的热化学方程式
。
(2)已知一个化学方程式可由另外几个化学方程式加减而得到,则该化学反应的能量变化即为这几个化学反应能量变化的代数和。
现有:298 K时
C(s,石墨) + O2(g) = CO2(g);ΔH1 = - 393.5 kJ/mol
CO(g) +  O2(g) = CO2(g);ΔH2 = - 283.0 kJ/mol
O2(g) = CO2(g);ΔH2 = - 283.0 kJ/mol
写出石墨在氧气中反应生成一氧化碳的热化学方程式
。
1.如下图所示,A、F为石墨电极,B、E为铁片电极。按要求回答下列问题。
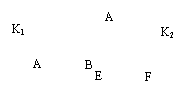
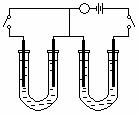
NaCl溶液 NaCl溶液
(1)打开K2,合并K1。
B为 极,A的电极反应为 ,最终可观察到的现象是 ,涉及的化学反应方程式有:
。
(2)打开K1,合并K2。
E为 极,F极的电极反应为 ,检验F极产生气体的方法是 。
(3)若往U型管中滴加酚酞,进行(1)(2)操作时,A、B、E、F电极周围能变红的是 ,原因是
。
11.珊瑚虫是海洋中的一种腔肠动物,它们可以从周围的海水中获取Ca2+和HCO3-,经反应形成石灰石的外壳:Ca2++2 HCO3- CaCO3+CO2↑+H2O。下列情况可以促进CaCO3产生的是
CaCO3+CO2↑+H2O。下列情况可以促进CaCO3产生的是
A.珊瑚周围有藻类植物生长
B.人类大规模砍伐森林
C.燃烧煤及其他的化石燃料
D.有更多的人潜水观看珊瑚
10.下列离子方程式书写正确的是
A.苯酚钠溶液中通入二氧化碳气体 C6H5O-+CO2+H2O→C6H5OH+CO32-
B.醋酸铵溶液和盐酸反应 CH3COONH4+H+ = CH3COOH+NH4+
C.向乙醇中加入金属钠 2CH3CH2OH+2Na→2CH3CH2ONa+ H2↑
D.向澄清石灰水中加入过量的碳酸氢钠溶液 Ca2++2OH-+2HCO3-= CaCO3↓+2H2O+CO32-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com