
题目列表(包括答案和解析)
29. (11分)土壤中有机物含量的高低是判断土壤肥力的重要指标,通常通过测定土壤中碳的含量来换算。方法如下:准确称取一定量的风干土样2.00g,加入10mL某浓度的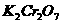 溶液,使土壤中的碳氧化,反应的化学方程式为:
溶液,使土壤中的碳氧化,反应的化学方程式为:
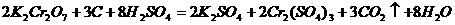
用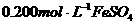 溶液,滴定溶液中剩余的
溶液,滴定溶液中剩余的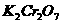 ,用去
,用去 溶液19.5mL,其反应的化学方程式为:
溶液19.5mL,其反应的化学方程式为:
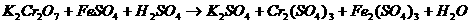 (未配平);另取一份等量相同浓度的
(未配平);另取一份等量相同浓度的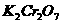 溶液,用相同的
溶液,用相同的 溶液滴定,用去
溶液滴定,用去 溶液49.5mL。试回答:
溶液49.5mL。试回答:
(1)配平下列化学反应方程式,并标出电子转移方向和数目:

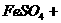
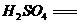
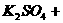
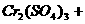
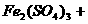
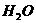
(2)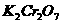 溶液的物质的量浓度
。
溶液的物质的量浓度
。
(3)土壤中碳的质量分数是 。
29.Ⅰ(1)C12H10O5(2分)
(2)5(2分) 加成(2分)
(3)
 Ⅱ(1)D(2分)
Ⅱ(1)D(2分)
(2)C8H8O2 (2分) 6(2分)
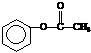 (2分)
(2分)
(2分)
(2分)
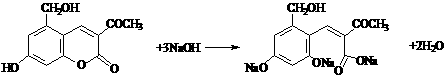
29.(Ⅰ)(8分)针对齐齐哈尔第二制药有限公司(以下简称齐二药)生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭一事,药品安全问题引起人们的关注。“亮菌甲素”结构简式如右图,是黄色或橙黄色结晶粉末,几乎不溶于水,辅料丙二醇(C3H8O2)溶成针剂用于临床。该药为利胆解痉药,适用于急性胆囊炎、慢性胆囊炎急性发作及慢性浅表性胃炎等。
(1)写出“亮菌甲素”的分子式_________________。
(2)1mol 亮菌甲素最多能和_______mol H2发生反应,该反应类型是_______反应。
(3)写出“亮菌甲素”和足量NaOH溶液完全反应的化学反应方程式:_________________。
(Ⅱ)(10分)含碳、氢、氧元素的下列有机物分子式通式:
A.Cn(H2O)m B.(C2H3)n(H2O)m C.(C2H)n(H2O)m
D.(CH)n(H2O)m E.(C2O)n(H2O)m F.(CO)n(H2O)m
(1)若充分燃烧某类有机物,消耗氧气的体积与生成二氧化碳的体积之比为5∶4(相同条件下),则该类有机物分子式通式是上述各式中的_________(填代号)。
(2)若某有机物分子式符合上述C的通式,其相对分子质量为136,写出该有机物的分子式_________;若该有机物属于酯类且分子中含有苯环,则其可能的同分异构体有_________种,写出其中不能发生银镜反应的同分异构体的结构简式___________________________
_________________________________________________。
28.(15分)
(1)H2、O2等 (1分)
(2)①溶液变浑浊(或溶液先变浑浊后又变澄清) (1分)盐酸的酸性比碳酸强,碳酸的酸性比次氯酸强 (1分) ②在甲、乙、丙中分别装入浓盐酸、高锰酸钾和溴化钠(或溴化钾等)溶液,反应中若观察到广口瓶中有黄绿色气体生成,试管中溶液由无色变为橙色,则可证明氧化性的强弱为:KMnO4>Cl2>Br2 (3分)(3)①Cu + 4HNO3(浓) == Cu(NO3)2 +2NO2↑+2H2O (2分)② c (1分) a、b (1分)
关闭弹簧夹a、b,打开弹簧夹c, 双手紧握(或微热)试管丁片刻使试管中气体逸出,NO2与水接触后即可引发烧杯中的水倒流入试管丁 (2分) ③ 防止氮的氧化物对空气的污染 (1分)
④ 1/22.4 mol/L(或0.045 mol/L) (2分)
28.(15分)某化学兴趣小组的同学利用下列实验装置进行物质的制备、性质等实验。
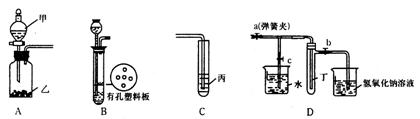
请按要求填空。
(1)利用A或B装置可制取的气体单质有(写出两种即可) 。
(2)A、C装置相连后可完成多种实验。
①若在甲、乙、丙中分别盛装的试剂为:稀盐酸、石灰石、次氯酸钙溶液,则实验开始后在试管丙中可观察到的为 ,该实验可说明相关酸的酸性强弱顺序是 。
②已知KMnO4在常温下可与浓HCl反应生成Cl2,请利用该装置设计一个简单的实验验证KMnO4、CI2、Br2的氧化性强弱
。
(3)当B中盛装浓硝酸和铜片(放在有孔塑料板上)后,可验证铜和浓硝酸的反应。
①B中发生反应的化学方程式为 。
②B、D装置相连后,可进一步验证NO2和水的反应。操作步骤为:
先关闭弹簧夹___________,再打开弹簧夹________,使NO2气体充满试管丁。欲使烧杯中的水进入试管丁,下一步应如何操作______________________________________
。
③盛NaOH溶液的烧杯的作用是___________________________________。
④当试管中的NO2和水充分反应后,所得溶液中溶质的物质的量浓度的最大值是___________(气体按标准状况计算)。
28.(除最后一空为3分外,其余每空2分,共17分) (5)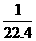 mol·L-1
mol·L-1
(1)Cu+4HNO3(浓)===Cu(NO3)+2NO2↑+2H2O
(2)无氮的氧化物逸出,可避免污染环境;可使反应随时进行,随时停止。
(3)C;a、b;C、E(4)关闭弹簧夹a、b,打开c,用手捂热试管②一段时间后松开
28.(17分)下图甲是旧教材中验证铜与浓硝酸反应的装置,乙是新教材对演示实验改进后的装置,丙是某校师生对乙作进一步改进并对所产生的气体的性质进行探究的装置。
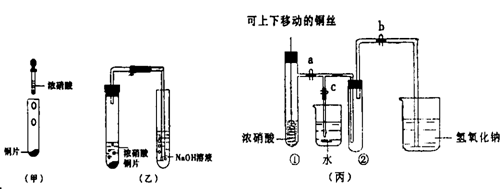 (1)写出铜和浓硝酸反应的化学方程式
。
(1)写出铜和浓硝酸反应的化学方程式
。
(2)与甲装置相比,乙装置的优点是 ,
丙装置除具乙装置优点外还具有的优点是 。
(3)欲使NO2气体充满试管②,应先关闭弹簧夹 ,再打开弹簧夹 ,当气体充满②后,将铜丝提起与溶液脱离,然后把a、b、c都关闭,并把试管②置于沸水中,下列情况不变的是 。
A.颜色 B.平均摩尔质量 C.质量 D.压强 E.密度
(4)为了验证NO2与水的反应,欲使烧杯中的水进入试管②的操作是
。
(5)试管②中的NO2和水充分反应后,所得溶液物质的量浓度最大值是 。(气体体积按标准状况计算且不考虑实验过程中NO2的损失)
28. (15分)(1)正(1分);氧气(1分)(2)阳(1分); (1分)
(1分)
(3)
 (3分)
(3分)
(4)在开始反应的短时间内,由于生成的氧气和氢气在水中溶解没达到饱和,而且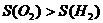 ,故
,故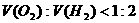 ;随着反应的进行,由于生成的氧气和氢气在水中溶解均达到饱和,故
;随着反应的进行,由于生成的氧气和氢气在水中溶解均达到饱和,故 (3分)(合理答案均给分)
(3分)(合理答案均给分)
(5)变小(2分)(6) (3分)(没写单位扣1分)
(3分)(没写单位扣1分)
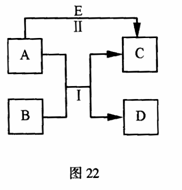 28.(12分)A、B、C、D、E是中学常见的五种物质,其转化关系如图22所示。反应I、II均在水溶液中进行,其中某些物质可能已略去。已知D是单质,C、E是化合物。
28.(12分)A、B、C、D、E是中学常见的五种物质,其转化关系如图22所示。反应I、II均在水溶液中进行,其中某些物质可能已略去。已知D是单质,C、E是化合物。
(1)若A是单质,其水溶液具有漂白性,D在常温
下为固态,且A、D均可使湿润的淀粉碘化钾试纸变
蓝。E是一种可溶性强碱,其焰色反应为黄色。
①A的电子式为 ;
C固态时的晶体类型为 ;
②写出反应II的离子方程式 ;
③在E的环境中,A与B还可以发生另外一个反应,
每1 mol B完全反应转移6 mol 电子,写出反应的
化学方程式 。
(2)若B是单质,工业上用电解氧化物的方法获得B。B元素原子的电子层数等于其最外层电子数。D是无色无味的气体,E是B的最高价氧化物的水化物。
①若C溶液显酸性,其原因用离子方程式表示为 ;
②若C溶液显碱性,则反应II的离子方程式为 。
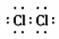 28.(12分)
28.(12分)
(1)① ………2分离子晶体…2分

 ②Cl2 +
2OH- Cl-+ ClO-+ H2O …2分③3Cl2 +
NaI + 6NaOH
NaIO3 + 6NaCl + 3H2O 2分
②Cl2 +
2OH- Cl-+ ClO-+ H2O …2分③3Cl2 +
NaI + 6NaOH
NaIO3 + 6NaCl + 3H2O 2分

 (2)①Al3+ +
3H2O
Al(OH)3+3H+ 2分②Al(OH)3 + OH- AlO2- + 2H2O
2分
(2)①Al3+ +
3H2O
Al(OH)3+3H+ 2分②Al(OH)3 + OH- AlO2- + 2H2O
2分
27. (14分)
(1)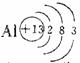 (1分)(2)离子(1分)
(1分)(2)离子(1分) (1分)
(1分)
(3)① 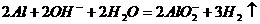 (2分)
(2分)
② 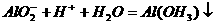 (2分)(4)酸(1分)
(2分)(4)酸(1分)

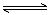
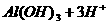 (2分)
(2分)
(5)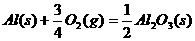 ;
; (4分)
(4分)
28. (15分)下图中
(15分)下图中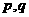 为直流电源两极,A为金属元素X的单质组成的活泼电极制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡。试回答:
为直流电源两极,A为金属元素X的单质组成的活泼电极制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡。试回答:
(1)p为 极,A极发生了 (填“氧化”或“还原”)反应;
(2)C为 极,试管里收集到的气体是 (化学式);
(3)C极的电极方程式 ;
(4)在电解过程中,测得了C、D两极上产生的气体的实验数据如下:
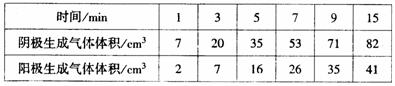
仔细分析以上实验数据,解释在电解过程中,阴极与阳极生成气体的体积比例变化的原因: ;
(5)当反应进行一段时间后,盛装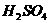 溶液的pH值 (填“增大”、“减小”或“不变”);
溶液的pH值 (填“增大”、“减小”或“不变”);
(6)当电路中通过 电子时,B电极上沉积金属X为
电子时,B电极上沉积金属X为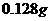 ,则此金属的摩尔质量为
。
,则此金属的摩尔质量为
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com