
题目列表(包括答案和解析)
19.(15分)甲、乙、丙为常见单质,乙、丙两元素在周期表中位于同一主族,丙为无色气体。X、A、B、C、D、E、F、G均为常见的化合物,其中A和X的摩尔质量相同。G的焰色反应为黄色。在一定条件下,各物质相互转化关系如下图:
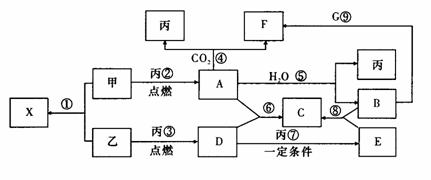
请回答:
(1)用化学式表示:丙为 ,C为 ,X的电子式为 , E为 (极性、非极性)分子。
(2)写出A与H2O反应的化学反应方程式
。
(3)写出B与G溶液反应的离子方程式: 。
(4)在上图的反应中,不属于氧化还原反应的是(填序号) 。.
18.(13分)短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素。
试回答下列问题:
(1)A在周期表中的位置_________________。
(2)A、B、C三种元素形成的简单离子的半径由大到小的顺序是________________(用离子符号表示)。
(3)A、C、D形成的化合物CD2、D2A、DA2中,各原子都满足最外层8电子结构的是__________________(请填写具体的化学式);B2A2所含化学键的类型有________________________。
(4)CA2与含1.5 molD的一种含氧酸(该酸的某盐在有催化剂存在的条件下常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,则该反应的化学方程式是______________________________________。
|
题序 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
第II卷(共52分)
17.(12分)有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液100mL,并向此稀释后的溶液中逐滴加入0.1mol/L的HCl溶液,产生的CO2气体体积(标况)与所加入的盐酸的体积之间的关系如下图所示:
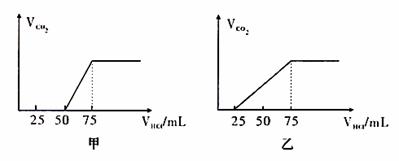
试分析(1).NaOH在吸收CO2气体后,在甲所得溶液中存在的溶质是 ,其物质的量之比是 ,
产生的CO2气体体积(标况)是 。
(2).乙所得溶液中存在的溶质是 。
其物质的量之比是 ,产生的CO2气体体积(标况)是 。
16. 某固体仅由一种元素组成,其密度为5g/cm3,用X射线研究该固体的结构表明,在边长1×10-7cm的立方体中含有20个原子,则该原子的相对原子质量最接近( )
A.32 B. 65 C. 120 D.150
 化学试题
化学试题
姓名 分数
15. 2.1克镁 铝合金完全溶于足量的盐酸,生成氢气2.24L(标况),再向溶液中加入NaOH溶液生成沉淀的质量最大是( )
A.2.9g B.4.6g C.5.5g D.6.9g
14.同主族两种元素原子的核外电子数的差值可能为:
A.6 B.12 C.30 D.26
13. 19.2毫克铜跟适量的浓硝酸反应,铜全部作用后共收集到气体8.96毫升(标准状况),反应消耗的HNO3的物质的量可能是( )×10-3摩尔.(不考虑NO2与N2O4之间的转化)
A.0.8 B.0.9 C.1.0 D.1.2
12.. 已知
① H2(g)+1/2O2(g)=H2O(g); △H1= a KJ/mol
② ②2H2(g)+O2(g)=2H2O(g); △H2= b KJ/mol
③ H2(g)+ 1/2O2(g)=H2O(l); △H3= c KJ/mol
④ ④2H2(g)+O2(g)=2H2O(l); △H4= d KJ/mol下列关系式中正确的是( )
A.a<c<0 B.b>d>0 C.2a=b<0 D.2c=d>0
11.下列说法正确的是:
A.H与D,16O2与18O2互为同位素
B.H216O、D216O、H218O、D218O互为同素异形体
C.在NaCl晶体中,每个氯离子周围都有8个钠离子
D.L层电子为奇数的所有短周期元素所在族的序数与该元素原子的L层电子数相等
10.下列说法正确的是:
A.ⅠA族元素的金属性比ⅡA族元素的金属性强
B.第三周期元素的离子半径从左到右逐渐减小
C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D.离子化合物一定含非金属元素
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com