
题目列表(包括答案和解析)
19.用6.02×1023表示阿伏加德罗常数的值,下列说法中正确的是
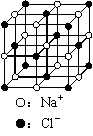 A.乙烯和丙烯的混合物1.4g中约含有6.02×1022个碳原子
A.乙烯和丙烯的混合物1.4g中约含有6.02×1022个碳原子
B.6.8 g熔融的KHSO4中含有6.02×1022个阳离子
C.23.4 g NaCl晶体中含有6.02×1022个右图所示的结构单元
D.电解精炼铜时转移了6.02×1022个电子,阳极溶解3.2 g铜
18.与铁相似,金属锡能溶于盐酸生成氯化亚锡,氯化亚锡又能被氯化铁氧化为氯化锡。则下列有关微粒氧化、还原能力的比较中,正确的是
A.氧化能力:Sn4+<Sn2+ B.氧化能力:Fe3+<Sn4+
C.还原能力:Fe2+<Sn2+ D.还原能力:Fe<Sn
17.某溶液中存在的离子有:S2-、HS-、OH-、Na+、H+:则下列对该溶液的有关叙述中正确的是
A.离子浓度一定是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
B.组成该溶液的溶质只能是Na2S或NaHS或两者的混合物
C该溶液可能呈中性,或碱性,或酸性
D.离子物质的量的关系一定是2n(S2-)+n(HS-)+n(OH-)=n(Na+)+n(H+)
16.短周期元素A、B、C原子序数依次递增,它们原子的最外层电子数之和为10,A和C处于同主族,B原子最外层电子数等于A原子次外层电子数,下列叙述不正确的是
A.原子半径:B>C>A
B.A、B、C的固态氧化物分别是分子晶体、离子晶体和原子晶体
C.A单质的熔点高于C单质的熔点
D.A与B或C均可形成离子化合物
15.常温下,甲、乙两种醋酸稀溶液,甲的pH=3,乙的pH=4,下列叙述正确的是
A.等体积的甲、乙两种溶液分别与足量的锌充分反应,甲中产生的H2大于10倍乙中产生的H2
B.物质的量浓度c (甲)=10 c (乙)
C.若把甲用水稀释至pH=4,则稀释后的体积小于原来溶液体积的10倍
D.将甲稀释10倍,溶液pH变为4
14.关于下列的实验描述中,错误的是
A.做乙酸乙酯的水解实验时,向加有乙酸乙酯的试管中加入适量NaOH溶液,并放在酒精灯火焰上加热
B.只用溴水就可以将苯、四氯化碳、苯酚溶液、乙醇、乙烯五种液体区别开来
C.除去CO2中混有的SO2,可将混合气体通过盛有饱和NaHCO3溶液的洗气瓶
D.现需1mol/L的NaOH溶液90mL,配制时需取用NaOH固体的质量为4.0g
13.脑白金中主要成分的结构简式如图。下列对脑白金主要成分的推断错误的是
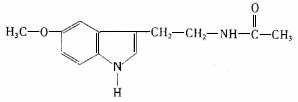
A.其分子式为C13H16N2O2 B.它能水解得到乙酸
C.该物质是苯的同系物 D.该物质不属于蛋白质或蛋白质的水解产物
12.纽扣电池的电极反应为:Zn+2OH-=ZnO+H2O+2e-;Ag2O+H2O+2e-=2Ag+2OH-。下列说法中,错误的是
A.Zn是负极,Ag2O是正极
B.电池放电时,电解质溶液的pH基本保持不变
C.Ag2O发生了还原反应
D.电池放电时,溶液中OH- 向正极移动,H+向负极移动
11.有人建议用AG表示溶液的酸碱度,AG定义为AG=lg[c(H+)/c(OH-)],在AG=12的某无色溶液中能大量共存的离子组是
A.Na+、Al3+、SO42-、NO3- B.K+、Na+、HCO3-、Cl-
C.NH4+、K+、Cl-、I- D.Cu2+、Fe2+、SO42-、NO3-
10.在密闭容器中,反应2A(g) 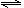 B(g)达到化学平衡时,平衡混合物中某组分质量分数(ω)与压强(p)和温度(T)的关系可用下图曲线表示。下列说法中,正确的是
B(g)达到化学平衡时,平衡混合物中某组分质量分数(ω)与压强(p)和温度(T)的关系可用下图曲线表示。下列说法中,正确的是
A.增大压强,混合气体平均相对分子质量增大
B.升高温度,平衡向正反应方向移动
C.纵坐标表示A的质量分数
D.该反应的△H>0
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com