
题目列表(包括答案和解析)
9.某学生的实验报告中有下列数据,其中合理的是 ( )
①用托盘天平称取11.7g氯化钠 ②用100mL的量筒量取21.48mL盐酸
③用容量瓶配制216mL,1mol·L-1的氯化钠溶液 ④用酸式滴定管量取25.00mL H2SO4溶液 ⑤用pH试纸测定H2SO4溶液的pH为3.2
A.①④ B.②④ C.①③ D.②⑤
8.下列各组离子,在指定的环境中一定能大量共存的是 ( )
A.在c(H+)/c(OH-)=1×1012的溶液中:I-、Cl-、HCO3-、Na+
B.由水电离出的c(H+)=1×10-12mol·L-1的溶液中:K+、Cl-、NO3-、Na+
C.在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、Cl-、
D.在能使pH试纸变红色的溶液中:Na+、S2-、NO3-、CO32-
7.下列物质按纯净物、混合物、电解质和非电解质顺序排列的是( )
|
|
纯净物 |
混合物 |
电解质 |
非电解质 |
|
A |
盐 酸 |
空 气 |
醋 酸 |
二氧化碳 |
|
B |
冰醋酸 |
福尔马林 |
硫酸钠 |
乙
醇 |
|
C |
蛋白质 |
油 脂 |
苛性钾 |
石灰石 |
|
D |
胆 矾 |
漂白粉 |
氯化钾 |
硫酸钡 |
6.下列说法中,你认为不科学的是 ( )
A.绿色食品是指不含任何化学物质的食品
B.食用含碘食盐可预防甲状腺肿大
C.使用含氟牙膏可预防龋齿
D.光导纤维是以二氧化硅为主要原料制成的高性能通讯材料
22.甲、乙两瓶新制氯水浓度均为0.1mol/L,如果向甲瓶中加入适量NaHCO3晶体,片刻后,甲、乙两瓶中HClO的物质的量的浓度关系是甲 乙(填大于、小于或等于),并比较盐酸、次氯酸、碳酸三种酸的酸性强弱
23计算题:合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3
(1)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4︰5,其中Fe2+与Fe3+物质的量之比为___________。
(2)当催化剂中Fe2+与Fe3+的物质的量之比为1︰2时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数为___________(用小数表示,保留2位小数)。
(3)以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2Fe2O3+C 4FeO+CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为_________g。
4FeO+CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为_________g。
21.实验室有一瓶混有少量NaCl杂质的NaOH固体试剂,为准确测其纯度,采用盐酸滴定法进行测定。
①称取WgNaOH固体试剂配制成100.00mL水溶液备用;
②将浓度为Cmol/L的标准盐酸装在用标准盐酸润洗过的25.00mL酸式滴定管中,调节液面位置在零刻度以下,并记下刻度;
③取V1 mL NaOH待测溶液置于洁净的锥形瓶中,加入2-3滴甲基橙指示剂充分振荡,然后用浓度为C mol/L的标准盐酸滴定,用去盐酸V2 mL,试回答:
(1)配制准确浓度的NaOH溶液;必须使用的主要仪器是______________。如有1mol/L和0.1mol/L的标准盐酸应选用_______mol/L盐酸。
(2)滴定终点时溶液颜色由__________突变为_____________色。
(3)若滴定前酸式滴定管尖嘴气泡未排出,滴定后气泡消失,会使碱测定值_________(偏大、偏小、无影响)。
(4)不用标准盐酸润洗酸式滴定管,会使碱测定值__________(偏大、偏小、无影响)。
(5)固体试剂NaOH纯度计算公式为 。
20.银器皿日久表面逐渐变黑色,这是由于生成硫化银,有人设计用原电池原理加以除去其处理方法为:取一内壁用NaOH溶液处理过的铝制易拉罐,放入一定浓度的食盐溶液,再将变黑的银器浸入溶液中,放置一段时间后,黑色会褪去而银不会损失。试回答:在此原电池反应中,负极发生的反应为______________。正极发生的反应为______________。原电池发生的总反应化学方程式为______________________。
19.航天技术中使用的氢氧燃料电池具有高能、轻便和不污染环境等优点。氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应方程式都可表示为2H2+O2=2H2O。酸式氢氧燃料电池的电解质是酸,其负极反应可表示为2H2-4e-=4H+,则正极反应表示为______________________;碱式氢氧燃料电池的电解质是碱,其正极反应表示为O2+2H2O+4e-=4OH-,则负极反应可表示为_________________________。
18.合金A由四种单质组成,经一系列反应后分别转化成沉淀或气体。
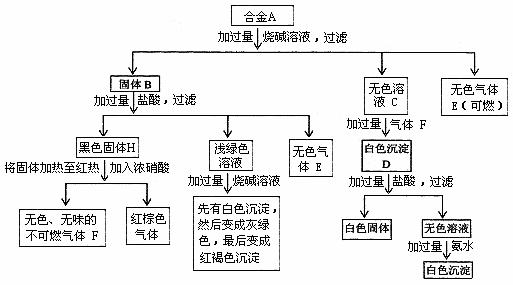
请回答下列问题:
(1)合金A由哪4种单质组成(写出化学式): _ 、 _ 、 _ 、 _ 。
(2)写出黑色固体H生成气体F的化学反应方程式 _ 。
(3)写出向无色溶液C通过量气体F生成白色沉淀D的有关反应的离子方程式:
、 。
17.称取三份锌粉,分别盛于甲、乙、丙三支试管中,按下列要求另加物质后,塞上导管塞子,定时测定生成氢气的体积。甲加入50 mL pH=3的盐酸,乙加入50 mL pH=3的醋酸,丙加入50 mL pH=3的醋酸及少量胆矾粉末。若反应终了,生成氢气的体积一样多,且没有剩余的锌,请用“>”“=”或“<”回答:
(1)开始时反应速率的大小为________。
(2)三支试管中参加反应的锌的质量为________。
(3)反应终了,所需时间为________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com