
题目列表(包括答案和解析)
20. (11分)下列物质均为中学化学常见物质,转化关系如右图所示,(反应条件及部分反应物、产物未全部标出)。
(11分)下列物质均为中学化学常见物质,转化关系如右图所示,(反应条件及部分反应物、产物未全部标出)。
(1)写出下列物质的化学式:
A:___________; K:___________。
(2)C与D的混合物通常叫做________________ (填名称)。
(3)写出下列反应的化学方程式(注明反应条件,若是离子反应的与离子方程式):
②:__________________________________________________________________:
③:__________________________________________________________________:
⑧:__________________________________________________________________:
⑨:__________________________________________________________________。
19. (10分)归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分)。
|
性质\元素 |
8O |
16S |
34Se |
52Te |
|
单质熔点(℃) |
-218.4 |
113 |
|
450 |
|
单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
|
主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
|
原子半径 |
逐渐增大 |
|||
|
单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请根据表回答下列问题:
(1) 硒的熔点范围可能是______________(2) 碲的化合价可能有_________________
(3) 硫、硒,碲的氢化物水溶液的酸性由强至弱顺序是_________________(填化学式)。
(4) 氢硒酸有较强的_________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为_______________________________________。
 (5) 工业上Al2Te3可用来制备H2Te,完成下列化学方程式:
(5) 工业上Al2Te3可用来制备H2Te,完成下列化学方程式:
____A12Te3 + ( ) 一( )A1(OH)3↓ +( )H2Te↑
⑹已知在常温下,生成17g H2S放出56.1KJ的热量,试写出硫化氢分解的热化学方程式
_________________________________。
(7) 右图所示为氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分别表示氧族中某一元素的单质,△H为相同物质的量的单质与H2反应的反应热。则:b代表________________,d代表_____________(均写单质名称)。
18.(12分)铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。
某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:

⑴ 试剂1是 ,试剂2是 ,加入新制氯水后溶液中发生的离子反应方程式是 , ;
⑵ 加入试剂2后溶液中颜色由淡黄色转变为淡红色是因为 ,
写出+2价Fe在空气中转化为+3价Fe的化学方程式 ;
⑶ 该同学猜想血红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗? 。若你认为合理,请说明理由(若你认为不合理,该空不要作答) ;若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要作答) 。
17.(10分)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO42-等杂质,不符合电解要求,因此必须经过精制。某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
步聚1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步聚2:向粗盐水中加入除杂试剂,然后进行过滤,滤去不溶物,再向滤液中加入盐酸调节盐水的pH;
步聚3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐;
请回答以下问题:
(1)上述实验中的过滤操作需要烧杯、____________、___________等玻璃仪器。
(2)步聚2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为:___________;
(3)步聚2中,判断加入BaCl2已过量的方法是:______________________;
(4)步聚2中,若先用盐酸调节pH再过滤,将会对实验结果产生影响,其原因是:
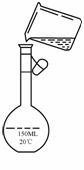 ________________________________________________;
________________________________________________;
(5)为检验精盐纯度,需配制150 mL 0.2 mol/L NaCl(精盐)溶液,上图是该同学转移溶液的示意图,图中的错误是________________________________________。
16、0.1mol/LKHSO4和0.1mol/LNa2S溶液等体积混合后,溶液能使pH试纸变蓝,则离子浓度关系正确的是
A.c(SO42-)>c(HS-)>c(OH-)>(H+)
B.c(Na+)>c(K+)>c(H+)>c(OH-)
C.c(Na+)=2c(S2-)+c(H2S)+c(HS-)+2(SO42-)
D.c(Na+)+c(K+)+c(H+)=c(SO42-)+c(S2-)+c(HS-)+c(OH-)
第Ⅱ卷
15、下列实验过程中产生的现象与对应的图形符合的是

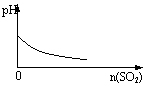
A.盐酸溶液中加入NaAlO2; B.SO2气体通入溴水中
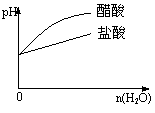

C.pH=2的醋酸与盐酸溶液分别加水稀释 D.氨气通入醋酸溶液中
14、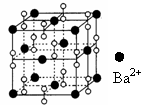 钡在氧气中燃烧时的得到一种钡的氧化物晶体,其结构如下图所示,有关说法正确的是
钡在氧气中燃烧时的得到一种钡的氧化物晶体,其结构如下图所示,有关说法正确的是
A.该晶体属于离子晶体 B.晶体的化学式为Ba2O2
C.该晶体晶胞结构与CsCl相似
D.与每个Ba2+距离相等且最近的Ba2+共有8个
13、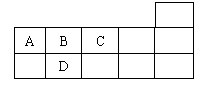 右表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述不正确的是
右表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述不正确的是
A.原子半径大小比较为D>B>C
B.生成的氢化物分子间均可形成氢键
C.A与C形成的阴离子可能有AC32-、A2C42-
D.A、B、C、D的单质常温下可能均不导电
12、下列各组离子在水溶液中能够大量共存,无论向溶液中加入哪种物质,只要使由水电离产生的c(OH-)=1×10-14mo1·L-1,溶液中都会有沉淀生成。该组离子可能是
A.NH4+、K+、Cl-、SO32- B.K+、Na+、SiO32-、AlO2-
C.Ba2+、Na+、HSO3-、NO3- D.Fe2+、NH4+、NO3-、C1-
11、现有下列四个图像:
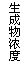
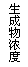

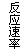
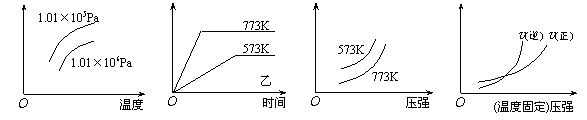
下列反应中全部符合上述图像的反应是
A.N2(g)+3H2(g)  2NH3(g);△H=-Q1kJ/mol(Q1>0)
2NH3(g);△H=-Q1kJ/mol(Q1>0)
B.2SO3(g)  2SO2(g)+O2(g);△H=+Q2
kJ/mol(Q2>0)
2SO2(g)+O2(g);△H=+Q2
kJ/mol(Q2>0)
C.4NH3(g)+5O2(g)  4NO+6H2O(g);△H=-808.7 kJ/mol
4NO+6H2O(g);△H=-808.7 kJ/mol
D.C(s)+CO2(g) 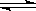 2CO(g);△H=+171.4kJ/mol
2CO(g);△H=+171.4kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com