
题目列表(包括答案和解析)
16.C 17.B 18.B19. B 20.B
11.C 12.A 13.B 14.D 15.B
6.D 7.A 8.C 9.D 10.C
1.A 2.B 3.A 4.B 5.C
24.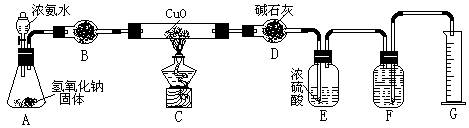 氨气与灼热的氧化铜反应生成铜、氮气和水。利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去)。回答下列问题:
氨气与灼热的氧化铜反应生成铜、氮气和水。利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去)。回答下列问题:
⑴写出氨气与氧化铜反应的化学方程式:2NH + 3CuO 3Cu + N+ 3HO 。
⑵在A的锥形瓶中放入NaOH固体的目的是利用NaOH的碱性和遇水放热的性质,使NH·HO 分解后逸出 。
⑶在干燥管B中不能选用的干燥剂是 C (填序号);
A.碱石灰 B.生石灰 C.五氧化二磷 D.氢气化钠
⑷在C的玻璃管中观察到的现象是:黑色固体变成了亮红色 。
⑸E装置中盛装浓硫酸的目的是:吸收多余的NH ;
⑹待实验完毕后,若实验测得N2的体积(折算成标准状况)a L,则被还原的氧化铜的物质的量为:3a/22.4mol;若测得干燥管D增重b g, 则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示)9a/11.2b 。
⑺上述实验中,如果省去B装置,测定氨分子组成的N、H原子个数的比值将会(填“增大”、“减少”或“无影响”)减少 ,理由是:因为由NH带出的水蒸气进入D装置,导致H原子的个数增加。
高三理科补习班化学练习题
(答案)
23.A、B、C、D、E5瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3和AgNO3中的一种。已知:
① A与B反应有气体生成; ② B与C反应有沉淀生成;
③ C与D反应有沉淀生成; ④ D与E反应有沉淀生成;
⑤ A与E反应有气体生成; ⑥ 在②和③的反应中生成的沉淀是同一种物质。
请填空:
⑴在②和③的反应中,生成的沉淀物质的化学式(分子式)是__ AgCl__。
⑵A是_ NaCO_ ,B是__ HCl__,C是_ AgNO__,D是_ BaCl_ ,E是_ NaHSO__。
⑶A与E反应的离子方程式是__2H++CO2-===CO+HO↑ 。
22.写出下列物质发生水解反应的离子方程式:
①Na2S ;
②CuSO4 ;
21.现有S2-、SO32-、NH4+、Al3+、HPO42-、Na+、SO42-、AlO2-、Fe3+、HCO3-、Cl-等离子,请按要求填空:
⑴在水溶液中,该离子水解呈碱性的是:S2-,SO2-,HPO2-,AlO-,HCO- 。
⑵在水溶液中,该离子水解呈酸性的是:NH+,Al3+,Fe3+ 。
⑶既能在酸性较强的溶液里大量存在,又能在碱性较强的溶液里大量存在的离子有:
Na+,Cl-,SO2- 。
⑷既不能在酸性较强的溶液里大量存在,又不能在碱性较强的溶液里大量存在的离子有:
HPO2-,HCO- 。
( A )1.
在一定条件下,某密闭容器中发生了如下反应:2SO2(g) + O2 (g)  2SO3(g) (正反应放热),反应达平衡后,SO2、O2、SO3的物质的量之比为3:2:5。保持其它条件不变,升温后达到新平衡时,SO2、O2的物质的量分别为1.4mol和0.9mol,此时容器内SO3的物质的量应为
2SO3(g) (正反应放热),反应达平衡后,SO2、O2、SO3的物质的量之比为3:2:5。保持其它条件不变,升温后达到新平衡时,SO2、O2的物质的量分别为1.4mol和0.9mol,此时容器内SO3的物质的量应为
A. 1.8mol B. 2mol C. 2.2mol D. 2.4mol
( B )2.
反应 2NH3(g) + CO2(g)  CO(NH2)2(s) + H2O(g)
已达平衡。若增大压强,平衡移动,但混合气体的平均相对分子质量不变。下列说法正确的是
CO(NH2)2(s) + H2O(g)
已达平衡。若增大压强,平衡移动,但混合气体的平均相对分子质量不变。下列说法正确的是
A. 原混合气体的平均相对分子质量为28 B. 原混合气体的平均相对分子质量为30
C. 起始时,NH3与CO2的体积比为13:14 D. 起始时,NH3与CO2的体积比为14:15
( A )3. 下列反应中,氧化剂与还原剂物质的量的关系为1∶2的是
A. O3+2KI+H2O==2KOH+I2+O2 B.2CH3COOH+Ca(ClO)2==2HClO+Ca(CH3COO)2
C. I2+2NaClO3==2NaIO3+Cl2 D. 3Cl2+6KOH =5KCl+KClO3+3H2O
( B )4.已知反应A2(g) + 2B2(g)
 2AB2(g)
的△H<0,下列说法正确的是
2AB2(g)
的△H<0,下列说法正确的是
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
( C )5.在1L 1mol / L的氨水中,说法正确的是
A.含1 mol NH3分子 B.含NH3和NH3·H2O之和为1 mol
C.含NH3、NH4+ 和NH3·H2O之和为1 mol D.含NH3·H2O为1 mol
( D )6. 下列物质中,常温下能起反应产生气体的是
A.铁和浓硫酸 B. 铝和浓硝酸 C.铜和稀盐酸 D. 铜和浓硝酸
( A )7. 在一定条件下发生下列反应,其中属于盐类水解反应的是
A. NH4++2 H2O 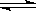 NH3·H2O + H3O+ B. HCO3-+H2O
NH3·H2O + H3O+ B. HCO3-+H2O 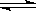 H3O++CO32-
H3O++CO32-
C. HS-+H+====H2S D. Cl2+H2O 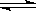 H++Cl-+HClO
H++Cl-+HClO
( C )8. 下列事实不能说明亚硝酸是弱酸的是
A. NaNO2溶液的pH值大于7 B. HNO2与同浓度的盐酸溶液作对比导电实验,灯泡很暗
C. HNO2不与NaCl反应 D. 室温下0.1 mol /L HNO2溶液的pH = 2.1
( D )9. 25℃时,在浓度为1 mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的溶液中,测得c(NH4+)分别为a、b、c(单位为mol/L)。下列判断正确的是
A. a = b = c B. a > b > c C. a > c > b D. c > a >b
( C )10. 物质的量浓度相同的三种盐 NaX、NaY 和 NaZ 的溶液,其中pH值依次为 8、9、10则 HX、HY、HZ 的酸性由强到弱的顺序是
A. HX、HZ、HY B. HZ、HY、HX
C. HX、HY、HZ D. HY、HZ、HX
( C )11. Na2CO3溶液中,存在多种分子和离子,下列关系式中不正确的是
A. c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
B. c(Na+)> c(CO32-)> c(OH-)>c(HCO3-)>c(H+)
C. c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
D. c(OH-)+c(HCO3-)+2c(CO32-)=c(H+)+c(Na+)
( A )12.下列溶液一定是碱性的是
A.溶液中c(OH-)>c(H+) B.pH>7的溶液
C.溶液中含有OH-
D.pH=3的CH3COOH与pH=11的NaOH溶液等体积混合
( B )13.下列各组离子中,在溶液中不能大量共存的是
A.S2-、NO3-、CO32-、K+ B.Al3+、Na+、S2-、SO42-
C.Al3+、NH4+、K+、SO42- D.Fe3+、Ca2+、H+、NO3-
( D )14.下列各组数据关系中,前者比后者大的是
A.纯水100℃和25℃时的pH
B.Na2CO3溶液中的HCO3-和OH-数目
C.常温下,pH=11的KOH溶液和pH=11的CH3COOK溶液中由水电离出的c(OH-)
D100mL0.1mol·L-1的CH3COOH溶液与10mL0.1mol·L-1的CH3COOH溶液的H+数目
( B )15.CH3COOH与CH3COONa等物质的量混合配制成的稀溶液,pH为4.7。下列说法错误的是
A.CH3COOH的电离作用大于CH3COONa的水解作用
B.CH3COONa的水解作用大于CH3COOH的电离作用
C.CH3COOH的存在抑制了CH3COONa的水解
D.CH3COONa的存在抑制了CH3COOH的电离
( C )16.下列说法中正确的是
A.HCO3-在水溶液中只电离,不水解 B.硝酸钠溶液水解后呈中性
C.可溶性的铝盐都能发生水解反应 D.可溶性的钠盐都不发生水解反应
( B )17.下列叙述中,正确的是
A.由极性键构成的一定是极性分子 B.由非极性键构成的一定是非极性分子
C.非极性分子中一定不含极性键 D.极性分子中一定不含非极性键
( B )18.将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度关系正确的是
A.c(NH4+)>c(Cl-)>c(H+)>c(OH-) B.c(NH4+)>c(Cl-)> c(OH-)>c(H+)
C.c(Cl-)>c(NH4+)>c(H+)>c(OH-) D.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
(AB)19.将相同物质的量浓度的某弱酸HX溶液与NaX溶液等体积混合,测得混合溶液中c(Na+)>c(X-),则下列关系错误的是
A.c(OH-)>c(H+) B.c(HX)<c(X-)
C.c(X-)+c(HX)==2c(Na+) D.c(HX)+c(H+)==c(Na+)+c(OH-)
(BD)20.一元酸HA溶液中,加入一定量强碱MOH溶液后,恰好完全反应,反应后的溶液中,下列判断正确的是
A.c(A-)≥c(M+) B.c(A-)≤c(M+)
C.若MA不水解,则c(OH-)<c(H+) D.若MA水解,则c(OH-)≥c(H+)
高三理科补习班化学练习题
姓名 班级
21.(12分)有如下化学反应:2A(g)+B(g) 2C(g),△H<0。
2C(g),△H<0。
I (1)若将4molA和2molB在2L的容器中混合,经2s后达到平衡,测得C的浓度为0.6mol·L-1,用物质A表示的平均反应速率为____________;2s时物质B的浓度为_______________;
(2)若将amolA和bmolB、cmolC在2L的容器中混合,经2s后,达到平衡测得C的浓度为0.6mol·L-1,如果反应是从逆方向开始到达平衡,则c的取值范围_______________;
II若把amolA和bmolB充入一密闭容器中,达到平衡时它们的物质的量满足:
n(A)+n(B)=n(C),则A的转化率为_________________;
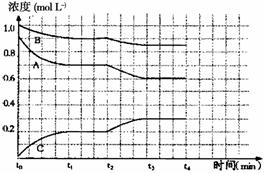 III若将4molA和2molB加入体积可变的等压容器中,一定温度下达到平衡状态,测得气体总物质的量为4.2mol。此时,混合气体中C的体积分数为_____________;若再通入少量B气体,体系中A的体积分数_____________(填“增大”、“减小”或“不变”),若要使A的体积分数再达到与原平衡状态相同,可采取的措施有____________________________。
III若将4molA和2molB加入体积可变的等压容器中,一定温度下达到平衡状态,测得气体总物质的量为4.2mol。此时,混合气体中C的体积分数为_____________;若再通入少量B气体,体系中A的体积分数_____________(填“增大”、“减小”或“不变”),若要使A的体积分数再达到与原平衡状态相同,可采取的措施有____________________________。
IV右图是一定条件下该反应过程中,体系内各物质浓度的变化情况。反应处于平衡状态的时间是________________,t2时曲线发生变化的原因是________________________________
高三理科补习班化学练习题
姓名 班级
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com