
题目列表(包括答案和解析)
24.(8分)下表是某温度下测得某酸溶液的一些数据,由表中的数据填空
|
溶液的物质的量浓度/mol·L-1 |
电离度/% |
H+的物质的量浓度/mol·L-1 |
pH |
|
0.1 |
2α |
c1 |
x |
|
c |
α |
2c1 |
3 |
则c == ; α== ; c1 == ; x ==
23. (10分)A、B、C、D均为含苯环的化合物,且式量B>A>C,已知有机物A的结构简式为:
(10分)A、B、C、D均为含苯环的化合物,且式量B>A>C,已知有机物A的结构简式为:
 (1)A既能和NaOH溶液反应,又能和NaHCO3溶液反应,写出A和NaHCO3溶液反应的化学方程式
。
(1)A既能和NaOH溶液反应,又能和NaHCO3溶液反应,写出A和NaHCO3溶液反应的化学方程式
。
(2)有机物B在浓H2SO4存在条件下,相互作用生成一种环状酯
(如右图)
则有机物B的结构简式为 。
等物质的量B与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、
NaHCO3的物质的量之比为 。
(3)D和B互为同异构体,且知苯环上的一氯代物只有两种,D不与NaHCO3反应,能与Na和NaOH反应,等质量的D消耗Na和NaOH的物质的量比为2:3,则D的结构简式为 。(只写一种)
(4)1molA、C完全燃烧,消耗O2的质量相等,且1 molC能和1 molNa完全反应,写出含碳原子数最少的C的结构简式 。
22.(5分)结构为 的物质与等物质的量的溴发生1,2加成反应或
1,4加成反应时,生成的加成产物有多种,写出这些加成产物的结构简式 。
21.(8分)已知常温常压下CO2在水中的溶解度不大,CO2与NaOH溶液反应时没有明显现象,某研究小组同学,设计了下图A-E五套装置,欲利用这些装置,能通过观察到的明显的现象,间接证明CO2与NaOH溶液发生了反应。
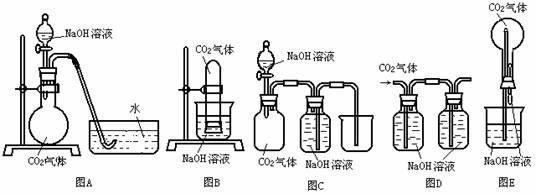
请选择以上实验装置,同时指出操作方法和观察到的实验现象,将答案填入下表:(表中已有一个示例)
|
所选装置 |
操 作 方 法 |
实 验 现 象 |
|
B |
将充有CO2试管的橡皮塞打开 |
水槽中NaOH溶液上升到试管中 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20.(6分)某学生将H2O2溶液滴入含有酚酞的NaOH溶液中,观察到溶液的红色消失。为了探究溶液褪色的原因,该同学查阅了资料:“过氧化氢(H2O2)是一种无色粘稠液体,有较强的氧化性,它的水溶液俗称双氧水,呈弱酸性。过氧化氢贮存时会分解为水和氧气。如在它的水溶液中加入少量二氧化锰,可以极大地促进它的分解。因此实验室里常用过氧化氢来制取氧气。”据此,该同学对溶液褪色的原因作出了两种假设,然后他又通过设计一个简单的实验,对这两种假设作了验证,证实有一种假设可能是错误的。
请回答:
(1)该同学作出的两种假设是什么?
(2)该同学设计了一个什么实验来证实其中一种假设可能是错误的?(说出该实验的方法及根据哪些现象作出判断)
19.(6分)在铝表面着色,先应用电解法使铝表面附上一层氧化铝,其方法将铝件作阳极,铁作阴极,用碳酸氢钠作电解液,进行电解。其原理是,通电后在铝件与电解液的接触面上逐渐形成一层Al(OH)3薄膜,薄膜的某些部位存在着小孔,电流从小孔通过并产生热量使Al(OH)3分解,从而在铝件表面形成一层较厚的氧化膜。
试回答:
(1)铝件表面形成氢氧化铝薄膜的电极反应式和离子反应式为:
(2)电解过程中,必须使电解液pH保持相对稳定(不能太大,也不能太小)的原因是 。
(3)使用NaHCO3溶液为电解液,会减缓阴极区溶液pH的增大,能说明这一原理的离
子方程式为 。
18. (7分)在溶液中进行某化学反应2A
(7分)在溶液中进行某化学反应2A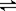 B+D在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10min-20min时间内平均速率(VA)为 mol/(L·min)。
(2)在实验2,A的初始浓度C2= mol/L,反应经20min就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1(填“>”、“=”、“<”),且C3 1.0 mol/L(填“>”、“=”、“<”)
(4)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。理由是 。
17.(4分)现有下列元素性质的数据:
 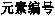  |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径(10-10m) |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
0.82 |
|
最高或最低化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
-2 |
|
|
-3 |
-1 |
|
-3 |
|
请确定以上8种元素在周期表中的位置,将元素的编号填入下表中:
   |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
1 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
14.下列离子方程式中正确的是
(A)向NaHSO4溶液中逐滴加入Ba(OH)2溶液,至SO42-沉淀完全:
2H++SO42-+Ba2++2OH-= BaSO4↓+2H2O
(B)碳酸钠与醋酸溶液反应:CO32-+2H+ = CO2↑+H2O
(C)氢氧化亚铁与硝酸混合;Fe(OH)2+2H+ = Fe2++2H2O
(D)将1 mL-2 mL氯化铁饱和溶液滴加到20 mL沸水中:
Fe3++3H2O  Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
 15.pH=11的X、Y两种碱溶液各10mL,分别稀释至1000mL。其
15.pH=11的X、Y两种碱溶液各10mL,分别稀释至1000mL。其
pH与溶液体积(V)的关系如右图所示,下列说法正确的是
(A)X、Y两种碱的物质的量浓度一定相等
(B)稀释后,X溶液碱性比Y溶液碱性强
(C)若9<a<11,则X、Y都是弱碱
(D)完全中和X、Y两溶液时,消耗同浓度盐酸的体积VX>VY
 16.盐酸洛派丁胺俗称易蒙停,它是一种新型止泻药物,适用于各种病因引起的急、慢性腹泻。其结构简式为
16.盐酸洛派丁胺俗称易蒙停,它是一种新型止泻药物,适用于各种病因引起的急、慢性腹泻。其结构简式为
·HCl
下列说法不正确的是
(A)易蒙停的分子式为C29H34Cl2N2O3
(B)向易蒙停中加入FeCl3溶液,溶液显紫色
(C)1mol 易蒙停只能与1 mol NaOH反应
(D)易蒙停能与溴水发生反应
13.最近,科学家冶炼出了纯度高达99.9999%的铁,根据所学化学知识判断该铁可能具有的性质有
(A)与相同浓度的盐酸反应生成氢气的速率比生铁快
(B)硬度比生铁高
(C)相同条件下比生铁易被腐蚀
(D)在冷的浓硫酸中可钝化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com