
题目列表(包括答案和解析)
33.(8分)[化学--有机化学基础]
有机物A、B、C、D、E、F有如下转化关系:
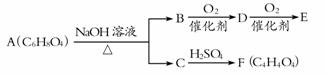
已知:①A可使溴水褪色,难溶于水 ②F无支链 ③E能发生银镜反应
请回答下列问题:
(1)E中所含官能团的名称是 ;
(2)F的结构简式为,与F具有相同官能团的同分异构体的结构简式为 ;
(3)由F制取A的化学方程式是 ;
(4)A不能发生的反应有 (选填序号)。
①加成反应 ②消去反应 ③加聚反应 ④氧化反应 ⑤酯化反应
32.(8分)[化学--物质结构与性质]
A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大。B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族。B、C、D的最高价氧化物的水化物均能互相发生反应生成盐和水。A和E可形成离子化合物,其晶胞结构如下图所示。
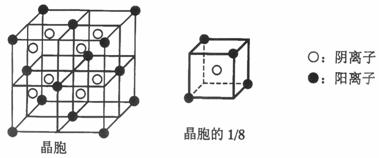
(1)D元素原子的价电子排布式是 ;
(2)A、B、C、D四种元素的原子半径由小到大的顺序为 (用元素符号表示);
(3)A和D的氢化物中,后者沸点较低,原因是 ;
(4)A和E的化合物晶体中,每个阳离子周围与它最近且距离相等的阳离子共有 个;
(5)已知A和E所形成化合物晶体的晶胞体积为1.6×10-22cm3,则A和E组成的化合物晶体的密度为 (结果保留一位小数)。
31.(8分)[化学--化学与技术]
碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:
6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2
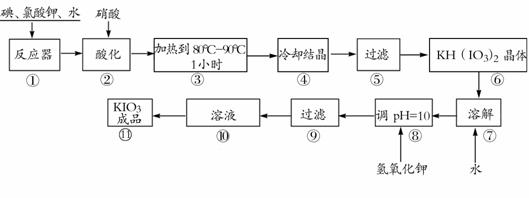
试回答下列问题:
(1)步骤①反应器发生的反应中,转移电子总数为 ;
(2)步骤②中,用硝酸而不用HI,其原因可能是 ;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为 ;
(4)实验中涉及两次过滤,在实验室进行过滤实验时,用到的玻璃仪器有 ;
(5)步骤⑧用氢氧化钾调节溶液的pH,反应的化学方程式为: ;
(6)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是 。
|
温度/℃ |
0 |
10 |
20 |
40 |
60 |
80 |
|
KIO3g/100g水 |
4.60 |
6.27 |
8.08 |
12.6 |
18.3 |
24.8 |
30.(15分)下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务。
[研究课题]探究草酸晶体受热分解的产物
[查阅资料]该小组同学通过网络查询,获得草酸及草酸晶体的一些相关知识:
|
名称 |
分子式 |
颜色、状态 |
溶解性 |
熔点(℃) |
|
草酸 |
H2C2O4 |
- |
易溶于水 |
189.5 |
|
草酸晶体 |
H2C2O4·2H2O |
无色晶体 |
- |
101.5 |
(备注:草酸晶体失去结晶水后,175℃以上开始分解)
[提出猜想](1) ;
(2)分解产物中气体可能是CO、CO2或它们的混合物。
[设计方案](1)请设计验证“猜想(1)”的实验方案。其中所使用的试剂是 ;
(2)化学学习小组的同学继续利用下图所示装置进行“猜想(2)”的实验探究。已知:A、C、F中盛装澄清石灰水,B中盛装浓NaOH溶液,D中装有碱石灰,E中装有CuO。
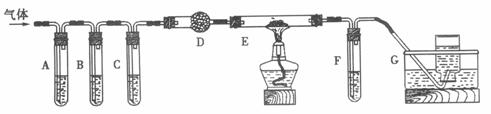
①证明分解产物中有CO2的现象是 ;
证明分解产物中有CO的现象是 ;
②装置B的作用是 ;
③若未连接装置G,要达到同样的目的,可采取的措施是 。
[交流讨论]小李同学继续查阅相关资料发现:草酸为二元弱酸,酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均为白色不溶物。小李进-步研究后,对实验中CO2的检验方案提出质疑。试根据相关信息,指出原设计中存在的问题,并提出实验的改进措施。 。
[实验结论]写出草酸晶体受热分解的化学方程式 。
[选做部分]
29.(13分)硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:
H2SO4=H++HSO4-,HSO4- H++SO42-。
H++SO42-。
请回答下列有关问题:
(1)Na2SO4溶液呈 (填“弱酸性”、“中性”或“弱碱性”),其理由是
(用离子方程式表示);
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为 ;
(3)在0.10mol·L-1的Na2SO4溶液中,下列离子浓度关系正确的是 (填写编号);
A.c(Na+)=c(SO42-)+c(HSO4-)+c(H2SO4)
B.c(OH-)=c(HSO4-)+c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-)
D.c(Na+)=2c(SO42-)+2c(HSO4-)
(4)写出NaHSO4溶液中溶质电离常数(Ka)的表达式 ;
(5)若25℃时,0.10mol·L-1的NaHSO4溶液中c(SO42-)=0.029mol·L-1,则0.10mol·L-1的H2SO4溶液中c(SO42-)0.029mol·L-1(填“<”、“>”或“=”),其理由是 ;
(6)如果25℃时,0.10mol·L-1H2SO4溶液的PH=-1g0.11,则0.10mol·L-1的H2SO4溶液中c(SO42-)= mol·L-1。
28.(14分)X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件
下可发生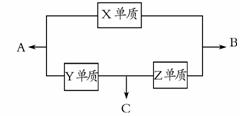 如右图所示变化:
如右图所示变化:
已知一个B分子中含有的Z元素的原子个数比一个C分子中少1个。
请回答下列问题:
(1)X元素在周期表中的位置是 ;
(2)X单质与Z单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性炭制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入 (填名称)气体;负极电极反应式为 ;
(3)C在一定条件下反应生成A的化学方程式是;
(4)已知Y单质与Z单质生成C的反应是可逆反应,△H<0。将等物质的量的Y、Z两种单质充入一密闭容器中,在适当催化剂和恒温条件下反应。下列说法中正确的是 (填写字母编号);
a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y单质的体积分数始终为50%
c.达到化学平衡时,Y、Z两种单质在混合气体中的物质的量之比为1∶1
d.达到化学平衡的过程中,气体平均相对分子质量逐渐增大
e.达到化学平衡后,再升高温度,C的体积分数增大
(5)在一个体积为10L的密闭容器中,充入2molY单质和8molZ单质,在一定温度下发生反应生成气体C,经40min后反应达到平衡,此时Z的转化率为37.5%。
①从反应开始到达平衡的40min内,用物质C表示的化学反应速率为 ;
②在该温度下,反应的化学平衡常数K= ;
③达到平衡后,若向容器中按1∶5∶2的物质的量比例再次充入Y、Z、C三种物质,则原平衡体系中Z的转化率将 (填“增大”、“减小”或“不变”)。
15.A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去):下列判断正确的是
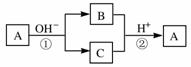 A.X元素可能为Al
A.X元素可能为Al
B.X元素不一定为非金属元素
C.反应①和②互为可逆反应
D.反应①和②一定为氧化还原反应
非选择题:
14.常温离子液体(又称常温熔融盐),是当前化学研究的热点和前沿。1914年报道的第一种离子液体硝酸乙基铵[(C2H5NH3)NO3]的熔点为12℃。已知C2H5NH2的化学性质与NH3相似,下列有关硝酸乙基铵的说法中,不正确的是
A.硝酸乙基铵的水溶液呈碱性
B.该离子液体可以作为电池的电解质
C.(C2H5NH3)NO3能与NaOH反应生成C2H5NH2
D.硝酸乙基铵水解的离子方程式可表示为:C2H5NH3++H2O C2H5NH2·H2O+H+
C2H5NH2·H2O+H+
13.不用其他试剂,限用化学方法区别下列两组内的四瓶溶液:
①FeCl3、BaCl2、MgSO4、Al2(SO4)3 ②Al2(SO4)3、HCl、BaCl2、K2CO3
则下列判断正确的是
A.只有①组可以 B.只有②组可以
C.两组都可以 D.两组都不可以
12.下列关于某些离子的检验说法中正确的是
A.向某溶液中加稀盐酸,将产生的气体通入澄清石灰水中,石灰水变浑浊,则原溶液中一定有CO32-
B.向某溶液中加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则原溶液中-定有SO42-
C.向氯化铵溶液中加入浓氢氧化钠溶液并加热,产生的气体一定能使湿润红色石蕊试纸变蓝
D.向某溶液中加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则原溶液中一定有Ba2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com