
题目列表(包括答案和解析)
7.下列离子方程式中不正确的是( )
A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+H++NH4++SO42-==BaSO4↓+H2O+NH3·H2O
B.碳酸氢钠溶液与硫酸氢钠反应:HCO3-+H+==CO2↑+H2O
C.向AlCl3溶液中滴加少量NaAlO2溶液:Al3++3AlO2-+6H2O==4Al(OH)3↓
D.漂白粉配制成的溶液中通入SO2: Ca2++2ClO-+SO2+H2O==CaSO3↓+2HClO
6.氮化碳结构如右图,其中β-氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料。下列有关氮化碳的说法不正确的是( )
A.氮化碳属于原子晶体
B.该晶体中的碳、氮原子核外都满足8电子稳定结构
C.氮化碳的化学式为C3N4
D.该晶体熔化时,共价键不受破坏
5.把NaHCO3和Na2O2的混合物放在密闭容器中加热,关于混合物加热前后与足量盐酸反应消耗盐酸的量,下列判断正确的是( )
A.加热前后一样多 B.加热前消耗的多
C.加热后消耗的多 D.当Na2O2适量时才会一样多
4.将0.2mol甲物质加入250mL 0.4mol·L-1的盐酸中,充分反应后,再加入0.1mol乙物质,在整个过程中,产生的H2在标准状况下的体积最多的是( )
|
|
A |
B |
C |
D |
|
甲 |
K |
K |
Na |
Al |
|
乙 |
Na |
Mg |
Al |
Mg |
3.某同学用Na2CO3配制0.10mol·L-1Na2CO3(aq)的过程如下图所示:
你认为该同学的错误有( )
A.1处 B.2处 C.3处 D.4处
2.下列是有关反应:N2H5++2H2O2==N2+4H2O+H+的叙述:①N2H5+被氧化;②H2O2是还原剂;③N2是还原产物;④生成1mol N2时,反应中电子转移总数为4NA。其中正确的是
A.只有① B.①② C.①④ D.全部( )
1.我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9m)恢复了磁性。“钴酞菁”分子结构和性质与人体内的血红素及植物内的叶绿素非常相似。下列关于“钴酞菁”分子的说法中正确的是( )
A.在水中所形成的分散系属悬浊液
B.“钴酞菁”分子既能透过滤纸,也能透过半透膜
C.分子直径比Na+小
D.在水中形成的分散系能产生丁达尔效应
21.(15分)有两只容积相等的密闭容器A和B,A容器保持恒容,B容器有一个可移动的活塞能使容器内保持恒压。起始时,向A容器充入2mol SO3和1mol O2, 向B容器充入2mol SO2与2molO2,保持400℃的条件下发生如下反应:
2SO2(g)+O2(g)≒ 2SO3(g);ΔH<0,并各自达平衡。填写下列空格:
(1)写出该反应的化学平衡常数表达式Kc= ,降低温度,该反应Kc值 ,(填增大、减小或不变,下同),化学反应速率 。
(2)达到平衡后,若向两容器中通入少量且相等的氩气,A容器化学平衡__________(填 “正向移动”、“逆向移动”、“不移动”或“无法确定”,下同),B容器的化学平衡_________________。
(3)达到平衡后,若向两容器中通入等量的原反应气体,达到新平衡时,A容器SO3的体积分数_______,B容器SO3的体积分数______。(填“增大”、“减少”或“不变”)
(4)达到平衡后,向容器B中再充入少量O2,SO2的转化率将________(填“增大”、“减小”、“不变”或“无法判断”)。
(5)达到平衡后,A容器中SO2的体积分数_______ B容器中SO2的体积分数(填“大于”、“小于”或“等于”)。
(6)若开始时在容器A中充入1mol SO2,同时充入 ,所到平衡与原平衡完全相同。
20.(13分)烃A可以从煤干馏得到,也是一种石油化工产品,工业上可用来制造一种常用炸药M。从烃A可以合成化合物F,它是用于制备治疗“非典”的药物“盐酸祛炎痛”的中间产物,其合成路线为:
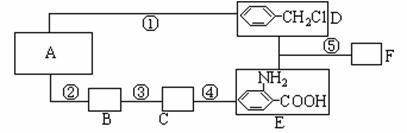
已知:①RNH2
+ R’CH2Cl 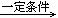 RNHCH2R’ + HCl (R和R’代表烃基)
RNHCH2R’ + HCl (R和R’代表烃基)
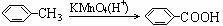 ② 苯的同系物能被酸性高锰酸钾溶液氧化,如
② 苯的同系物能被酸性高锰酸钾溶液氧化,如
 ③
(弱氧化性,易氧化)
③
(弱氧化性,易氧化)
 ④
与浓硫酸、浓硝酸混合在不同温度下会得到不同产物
④
与浓硫酸、浓硝酸混合在不同温度下会得到不同产物
⑤
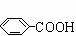 与浓硫酸、浓硝酸混合反应能生成间硝基苯甲酸。
与浓硫酸、浓硝酸混合反应能生成间硝基苯甲酸。
回答下列问题:
(1)C的结构简式是_____________________。
(2)D+E→F的化学方程式_________________________________。
(3)E在一定条件下可聚合成热固性很好的功能高分子,写出合成此高聚物的化学方程式____________________________________________________________________。
(4)反应①~⑤中,属于取代反应的是(填反应序号)____________________。
(5)已知在20℃时,0.1mol炸药M爆炸时可以放出Q kJ的热量,则炸药M在20℃时分解反应的热化学方程式为_____________________________________________。(没有氧气参与反应,且氢元素和氮元素在产物中分别以水和氮气的形式存在)
17.(3分)下列实验操作正确的是
A.向一支洁净的试管中加人2mL3%硝酸银溶液,再向试管中滴加氨水至产生的沉淀恰好溶解为止,加入乙醛溶液,水浴加热,片刻后将在试管内壁形成银镜。
B.实验室制取乙烯时,必须将温度计的水银球插入反应液中。
C.取2mL4mol/LNaOH溶液于试管中,加入2mL2mol/LCuSO4溶液,再加入某种有机试剂,加热,可根据是否产生红色沉淀判断该有机物中是否含有醛基。
D.分离苯和苯酚的混合液,可向混合物中加人适量浓溴水,过滤、分液,即可实现。
E.用碱式滴定管量取12.00mLNaOH溶液
F.无水乙醇与冰醋酸共热制取乙酸乙酯
 18.(6分)现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(约6mL)和检验氯气的氧化性(不应将多余的氯气排入空气中)。
18.(6分)现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(约6mL)和检验氯气的氧化性(不应将多余的氯气排入空气中)。
(1)试从上图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是:A接____,____接______,B接_____,____接______;
(2)炭棒接直流电源的________极;
(3)能说明氯气具有氧化性的实验现象是__________________________________ _;
(4)假定装入的饱和食盐水为50mL(电解前后溶液体积变化可忽略),当测得的氢气为5.6mL(标准状况)时停止通电。摇匀U形管内的溶液后溶液的pH约为__________。
 19.(15分)已知C、D、E、H为气体,反应①是工业生产中的重要反应,反应④⑥⑧是实验室重要的物质检验反应,这些物质有如图所示的转化关系(生成物中的水均已略去)。
19.(15分)已知C、D、E、H为气体,反应①是工业生产中的重要反应,反应④⑥⑧是实验室重要的物质检验反应,这些物质有如图所示的转化关系(生成物中的水均已略去)。
试回答:
(1)写出下列物质的化学式。F __________ H____________
(2)反应⑦中A溶液显示的性质是___________(填序号)
A.氧化性 B.还原性 C.酸性
(3)若X是一种能溶于水的复盐,则组成它的阴阳离子是_______________。
(4)写出下列反应的离子方程式。
反应①________________________________________________________;
反应③________________________________________________________;
反应⑤_______________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com