
题目列表(包括答案和解析)
2.Na2CO3溶液中滴加盐酸过程不清楚。
在Na2CO3溶液中滴加HCl,CO32-先转化为HCO3-,再滴加盐酸HCO3-转化为H2CO3,不稳定分解为CO2。
如:在10mL0.01mol/L纯碱溶液中,不断搅拌并逐滴加入1.2mL0.05mol/L盐酸,完全反应后在标准状况下生成二氧化碳的体积为(1998年上海高考题)
A.1.334mL B.2.240mL C.0.672mL D.0mL
思路分析:反应过程为:CO32-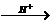 HCO3-
HCO3-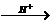 CO2。
CO2。
盐酸溶液中n(HCl)=0.00006mol,纯碱溶液中n(Na2CO3)=0.0001mol
CO32- + H+ = HCO3-
1.CO2通入NaOH溶液的判别错误。
CO2通入NaOH溶液的反应与CO2气体通入量有关。当CO2通入少量时生成Na2CO3,当CO2通入过量时生成NaHCO3,CO2通入量介于两者之间,既有Na2CO3又有NaHCO3。因此推断产物时一定要注意CO2与NaOH间量的关系。
4.两物质反应产物还能继续与反应物反应的有哪些?----NH3(+O2)→NO(+O2)→NO2,H2S(+O2)→SO2(+O2)→SO3,C(+O2)→CO(+O2)→CO2,O2(+C)→CO2(+C)→CO
3.能与镁条燃烧的气体有哪些?------CO2,SO2、O2、N2
2.与过氧化钠产生两种产物的气体有哪些?-------CO2,H2O
0.1mol 0.1mol
则应生成CaCO3质量为0.1mol×100g mol-1=10g,现只生成9g沉淀,说明13.8g CO32-只有0.09mol,则在NaNO3、Na2CO3二种杂质中,必含有不与CaCl2反应的KNO3存在,C错。
肯定存在KNO3时,是否可能含有Na2CO3?由于0.09molK2CO3质量为m(K2CO3)= 0.09mol×138m.mol-1=12.42g,故可能存在K2CO3、Na2CO3共0.09mol,再加入KNO3使总质量达到13.8g的可能性,则在存在KNO3的前提下,可能有Na2CO3存在,B对,D错。
上述思考过程中,涉及的计算,有些不必精确算出结果,只须估计即可,这样可以节省时间。
答案:A、B
方法要领:根据实验现象、结合所给数据利用极限思想解题。
例9 汽车尾气(含烃类、CO、SO2与NO等物质)是城市空气的污染源。治理方法之一是在汽车排气管上装一个“催化转换器”(用铂、钯合金做催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。(1998年上海市高考题)
(1)写出一氧化碳与一氧化氮反应的化学方程式 。
(2)“催化转换器”的缺点是在一定程度上提高了空气的酸度,其原因是 。
(3)控制城市空气污染源的方法可以有( )
A.开发氢能源 B.使用电动车 C.植树造林 D.戴上呼吸面具
思路分析:本题涉及的反应产物均隐含在题中,只有认真分析才能得出正确的结论。如NO与CO反应产物是参与大气循环的无毒气体,排除NO2等有毒气体,也排除生成的单质碳,同时也不可能是不常见的气体,只能是空气中存在的N2和CO2。又因催化转换器中的铂、钯合金是SO2与O2生成SO3反应的催化剂,这样就合理解释了空气酸度的增加。控制城市空气污染当然不能靠戴呼吸面具,植树造林虽是环保的重要措施,但不会直接关系到城市污染的控制。
答案:(1)2CO+2NO=2CO2+N2;(2)SO2转化为SO3,产生硫酸酸雾;(3)A、B
方法要领:因为“CO与NO反应,生成可参与大气生态环境循环的无毒气体”,所以这气体是CO2和N2;(2)SO2可被氧化SO3,与水蒸气形成硫酸酸雾;(3)在控制城市空气污染的方法中,植树造林这一选项具有一定的迷惑性,植树造林能控制CO2量的增加,是改善环境的一种重要手段,而对消除汽车尾气中烃类、CO、SO2与NO等物质没有直接的效果。戴上呼吸面具是一种防止污染的方法,并不能减小污染。
 例10 下图是石英晶体平面示意图:
例10 下图是石英晶体平面示意图:
-Si-O-Si-O-Si-
O O O
-S-O-Si-O-Si-
O O O
它实际上是立体的网状结构,其中硅和氧的原子数之比为 。原硅酸根离子SiO44-的
 O
O
结构可表示为 O-Si-O 二聚硅酸根Si2O76-只有硅氧键,它的结构可以表示为 。
O
思路分析:从示意图中的结构可以看出每个Si原子结合了四个O原子,而每个O只结合了二个Si,所以在二氧化硅晶体中硅原子与氧原子的最简个数比为1:(4×1/2)=1:2,原硅酸(H4SiO4)
 O-H
O-H
的结构可以表示为:H-O-Si-O-H,两个原硅酸分子可发生分子间脱水,生成二聚硅酸
O-H
(H6Si2O7):
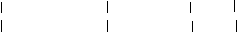 OH
OH
OH OH
OH
OH
OH OH
 HO-Si---OH + H O-Si--OH→ HO-Si-O-Si-OH + H2O
HO-Si---OH + H O-Si--OH→ HO-Si-O-Si-OH + H2O
OH OH OH OH O O
二聚硅酸脱去6个H+形成带6个单位负电荷的阴离子(二聚硅酸根离子):O-Si-O-Si-O
O O
方法要领:根据物质的空间结构,结合数学空间几何知识和思想、方法,推断出组成晶体的微粒(原子或离子)个数比,推出晶体的化学式。
 该题在含氧酸的考查中经常出现:如:焦硫酸、多聚磷酸等。可采用同样的方法求解。
该题在含氧酸的考查中经常出现:如:焦硫酸、多聚磷酸等。可采用同样的方法求解。
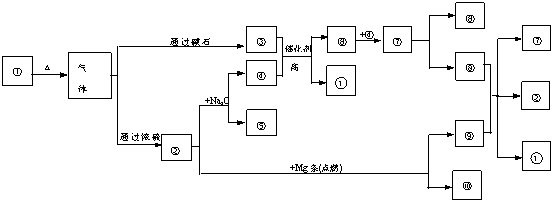 例11 下图中①- 分别代表有关反应中的一种物质,请填写以下空白。
例11 下图中①- 分别代表有关反应中的一种物质,请填写以下空白。
 (1)①、③、④的化学式分别是
、 、
(1)①、③、④的化学式分别是
、 、
(2)⑧与⑨反应的化学方程式是
 思路分析:本题的突破口就在题目的开始部分。因为这一部分把反应条件和部分反应物都已列出,为推断物质提供的充足的已知条件。气体混合物通过碱石灰后得氨气③,通过浓H2SO4可得CO2气体,CO2气体与Na2O2反应得氧气④,氨气和氧气在催化剂作用下加热反应得NO⑥,NO和O2反应生成NO2⑦,与H2O反应生成HNO3⑧,CO2与Mg条点燃后生成MgO⑩和C⑨、C与HNO3反应生成NO2⑦,CO2②和H2O ,所以①是NH4HCO3。
思路分析:本题的突破口就在题目的开始部分。因为这一部分把反应条件和部分反应物都已列出,为推断物质提供的充足的已知条件。气体混合物通过碱石灰后得氨气③,通过浓H2SO4可得CO2气体,CO2气体与Na2O2反应得氧气④,氨气和氧气在催化剂作用下加热反应得NO⑥,NO和O2反应生成NO2⑦,与H2O反应生成HNO3⑧,CO2与Mg条点燃后生成MgO⑩和C⑨、C与HNO3反应生成NO2⑦,CO2②和H2O ,所以①是NH4HCO3。
答案:(1)NH4HCO3、NH3、O2;(2)C+4HNO3=2H2O+4NO2↑+CO2↑
引申发散:1.热分解全是气体的是何物?-----碳酸铵或碳酸氢铵,亚硫酸铵
4.不要把Na2CO3+SiO2 Na2SiO3+CO2↑与Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓相混。前者是工业制玻璃的反应式之一,是在高温条件下发生的反应,而后者是在水溶液中发生的反应。若交换条件,两者均不发生反应。
Na2SiO3+CO2↑与Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓相混。前者是工业制玻璃的反应式之一,是在高温条件下发生的反应,而后者是在水溶液中发生的反应。若交换条件,两者均不发生反应。
[典型例题评析]
例1 已知天然气的主要成份CH4是一种会产生温室效应的气体,等物质的量的CH4和CO2产生的温室效应,前者大。下面是有关天然气的几种叙述:①天然气与煤、柴油相比是较清洁的能源;②等质量的CH4和CO2产生的温室效应也是前者大;③燃烧天然气也是酸雨的成因之一.其中正确的是(2001年理科综合能力测试第10题)
A.是①②③ B.只有① C.是①和② D.只有③
思路分析:大气中的CH4和CO2为红外线吸收体,它们吸收太阳和地球的长波辐射,并将其中一部分反射回地球。因此,大气中CH4和CO2浓度增加,则阳光被吸收得多,反射到太空的部分减少,地表温度将上升。天然气燃烧产物为CO2和水,而煤和柴油燃烧产物会造成污染。对等质量的CH4和CO2,CH4的物质的量比CO2多,由题意知等质量的CH4和CO2产生的温室效应CH4大,但CO2不是形成酸雨的物质。
答案:C
方法要领:CO2导致“温室效应”是人们所熟知的常识,但本题告诫人们,CH4也是一种会产生“温室效应”的气体,且等物质的量的CH4产生“温室效应”比CO2还要大。纵观当今世界范围内都在呼吁控制CO2的排放量以遏制“温室效应”的加剧,同时又在为保护环境号召多使用清洁能源--天然气。殊不知,事物都是一分为二的,就像天然气,既有有利的一面,也有有害的一面。本题让人们意识到利用天然气作燃料的同时,一定要防止其泄漏。
例2 下列物质不属于“城市空气质量日报”报道的是(2001年上海高考题)
A.二氧化硫 B.氮氧化物 C.二氧化碳 D.悬浮颗粒
思路分析:二氧化硫、氮氧化物和悬浮颗粒均为大气污染物,只有二氧化碳不需报道。
答案:C
方法要领:SO2主要来自含硫煤燃烧时的排放。其危害一方面是由于本身的刺激性会影响人的呼吸系统和眼睛,另一方面还由于能与空气中的其它污染物相互影响,产生所谓的“协同效应”,可导致更为严重的后果。氮氧化物中造成空气污染的主要是NO和NO2,习惯上可用NOx来表示。氮氧化物主要来自汽车尾气排放,汽车内燃机运转时,高温和电火花条件使缸内N2和O2反应生成氮氧化物。两种氮氧化物中,二氧化氮的毒性要比NO高4-5倍,人吸入NO2后,首先对呼吸道产生刺激作用,浸入肺部后,又与细胞中的水分结合而生成硝酸和亚硝酸,造成肺水肿。NO2吸收紫外光后被分解:NO2 NO+O,生成的O非常活泼,再继续发生一系列化学反应,最后导致光化学烟雾,这是NO2造成的另一危害。
NO+O,生成的O非常活泼,再继续发生一系列化学反应,最后导致光化学烟雾,这是NO2造成的另一危害。
大气中悬浮的大小在10微米以内的颗粒,因鼻腔无法将其阻挡,可进入人体的呼吸道和肺部,被称为可吸入颗粒。这些颗粒不仅仅是尘土,还在表面吸附了其它污染物,因此吸入后可能引起多种病变。
例3 向下列溶液中通入过量CO2,最终出现浑浊的是(2000年全国高考题)
A.氢氧化钙饱和溶液 B.苯酚钠饱和溶液
C.醋酸钠饱和溶液 D.氯化钙饱和溶液
思路分析:当足量CO2通入Ca(OH)2饱和溶液时,由于其为二元酸,故可生成溶于水的酸式盐Ca(HCO3)2而“最终”无浑浊。而当遇苯酚钠时,由于碳酸的酸性较苯酚的酸性强,故可生成苯酚。又由于苯酚在常温下的溶解度不大,故最终出现浑浊。而C、D两选项中,由于醋酸、盐酸的酸性较碳酸强,故CO2与其均不可反应。A中先有沉淀后又溶解;B中出现浑浊;C和D中无反应发生。
答案:B
方法要领:本题原理不难,但由于考生审题不严及粗心,很易错选。本题的“题眼”在“过量CO2”。如:若看不到“最终”或“足量CO2”,很易因为氢氧化钙能与二氧化碳反应而错选。故提醒考生,答好选择题的关键是审题,正确应用好关键字句,避免疏忽错误。
例4 将CO2气体通入CaCl2溶液,若要有白色沉淀产生,可加入的试剂是(1997年上海高考题)
A.硫酸氢钾溶液 B.碳酸氢钙溶液 C.氯水 D.氢氧化钠溶液
 思路分析:在CaCl2溶液中:CaCl2=Ca2++2Cl-;CO2通入溶液中存在如下平衡:CO2+H2O H2CO3、
思路分析:在CaCl2溶液中:CaCl2=Ca2++2Cl-;CO2通入溶液中存在如下平衡:CO2+H2O H2CO3、

 H2CO3 H++HCO3-、HCO3- H++CO32-。
H2CO3 H++HCO3-、HCO3- H++CO32-。
在CO2和CaCl2的混合溶液中,加入的各物质电离为:
A中:KHSO4=K++H++SO42-;B中:Ca(HCO3)2==Ca2++2HCO3-;C中:Cl2+H2O==H++Cl-+HClO;D中:NaOH=Na++OH-
要产生沉淀,必须使H2CO3的电离平衡右移,以增加[CO32-],方能有CaCO3沉淀生成,纵观选项中四种物质,只有D中的NaOH电离的OH-离子可中和H+使电离平衡右移,使CO32-浓度增加至足以与Ca2+结合为CaCO3沉淀。
答案:D
方法要领:当CO2通入碱溶液中,才能生成CO32-,此时与Ca2+结合形成CaCO3沉淀。而A、C显酸性,不可能形成CO32-。碳酸氢钙中虽然有大量的Ca2+和HCO3-,但CO32-的量仍然很少,所以无法形成CaCO3沉淀。
阴阳离子要结合生成难溶于水的沉淀物,必须使阴阳离子的量都达到一定的数值。如只有阳离子无阴离子或阴离子极少,是不能形成沉淀的。反过来只有阴离子无阳离子或阳离子极少也是不能形成沉淀的。
运用电离平衡的知识解决化学反应现象。CO2气体通入CaCl2溶液中,是不能产生沉淀的,这是由于碳酸是弱酸,不能与强酸盐反应生成强酸:HCl。大家熟知的“弱酸不能制强酸”的实质,仍然离不开电离平衡移动原理的解释。
运用“强酸制弱酸”原理时需注意如下两点:①强酸制弱酸原理是指强酸可与弱酸盐发生复分解反应的原理;②这一规律也有例外,如H2S+CuSO4=CuS↓+H2SO4,这是因为生成的CuS极难溶于水的缘故。
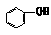 例5 已知酸性强弱顺序为H2CO3> >HCO
例5 已知酸性强弱顺序为H2CO3> >HCO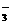 ,下列化学方程式正确的是(1998年上海高考题)
,下列化学方程式正确的是(1998年上海高考题)

思路分析:已知酸性H2CO3>C6H5OH>HCO3-,即碱性CO32->C6H5O->HCO3-,根据较强的酸可以制取较弱的酸,较强碱可制取较弱的碱的原理,A、D是错误的。
答案:B、C
方法要领:“强酸制弱酸”的实质是电离能力强的物质可生成电离能力弱的物质。
例6 CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属离子型碳化物,判断下列反应产物正确的是(1997年高考化学试测题)
A.ZnC2水解生成乙烷(C2H6) B.Al4C3水解生成丙炔(C3H4)
C.Mg2C3水解生成丙炔(C3H4) D.Li2C2水解生成乙烯(C2H4)
思路分析:由CaC2+2H2O→Ca(OH)2+C2H2↑,借用其规律作模仿,可以从各种角度考虑。
考虑方法(1):假定钙、氢、氧的化合价在反应前后都没有变化,从CaC2来看,钙是+2价、C22-是-2价,相当是-2价的烃,所以产物是乙炔(C2H2)。类比可知,ZnC2水解也应该是乙炔(C2H2);Al4C3水解的C3应该表现-12价,只能是3个甲烷(CH4);Mg2C3水解的C34-应该表现-4价,产物为C3H4;Li2C2水解的C22-是-2价,还是乙炔。检查选项只有C对。
答案:C
一题多解:考虑方法(2):假定碳化物中的金属元素都水解成为氢氧化物,那么,每用去一个氢氧根都会多出一个氢原子,这些氢原子与反应物中的碳原子分配。因此,CaC2产物是Ca(OH)2、C2H2,ZnC2、Li2C2也都得到C2H2,Al4C3得到“C3H12”,只能是3CH4,Mg2C3应得到C3H4。
方法要领:本题新颖,希望考生用已有的一个代表性的化合物的性质摸索其规律,再用这个规律去解决新问题。所用方法没有常规,题海中也没有。考查了思维能力,创造能力。
解题中根据水解原理写出化学方程式或用电荷守恒原理,把金属阳离子所带的总电荷数用等量的H+替代,即得产物的分子式。作为第ⅣA族、第二周期的碳,一般情况下难以形成离子,通常在化合物中以共价键的形式存在。但当其与某些较活泼的金属在高温下形成无机化合物时,也可以以阴离子的形式存在。这些金属碳化物与水极易发生彻底的水解,生成对应的碱和某些烃类化合物。
例7 纯净的Ca(HCO3)2试样在高温下分解,当剩余固体是原试样质量的一半时,它的分解率为(1996年上海市高考题)
A.50% B.75% C.92.5% D.100%
思路分析:若Ca(HCO3)2按下式完全分解:
Ca(HCO3)2==CaCO3+CO2↑+H2O
162 100
剩余固体质量为原试样的100/162,大于1/2,故伴随着发生进一步分解:
CaCO3==CaO+CO2↑
答案:D
方法要领:掌握碳酸盐的分解规律:一般来说,热稳定性大小的顺序为:正盐>酸式盐(成盐离子相同)。考虑问题要周密,防止只考虑第一步反应,而忽略了第二步分解反应。
例8 某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或二种。现将13.8克样品加入足量水,样品全部溶解。再加入过量的CaCl2溶液,得到9克沉淀,对样品所含杂质的正确判断是(1996年上海高考题).
A.肯定有KNO3 B.肯定有KNO3,可能还含有Na2CO3
C.肯定没有Ba(NO3)2,可能有KNO3 D.肯定没有Na2CO3和Ba(NO3)2
思路分析:根据“加足量水,样品全部溶解”这一种条件,可确定不可能含有Ba(NO3)2杂质,否则会与K2CO3生成BaCO3沉淀。因此对杂质成分的判断集中在KNO3和Na2CO3是否存在这一问题。
根据反应的关系,假定13.8g样品全部是K2CO3,则n(K2CO3)=13.8g/138 g.mol-1=0.1mol。
按加入CaCl2生成CaCO3沉淀的量关系,有:
K2CO3-CaCO3
3.CO2通入CaCl2溶液中是否有沉淀的分析错误。
可用反证法:如能产生沉淀,则反应的化学方程式为:CO2+CaCl2+H2O=CaCO3↓+2HCl。因CaCO3溶于盐酸,故反应不能发生。因为CO2只有通入中性或碱性溶液才能产生CO32-,并同时产生部分H+,若原溶液无法消耗这部分H+,则不利于CO2转化为CO32-,也就无法与Ca2+形成沉淀。若要使CaCl2与CO2反应生成沉淀,就必须加入部分碱溶液中和CO2与H2O反应而产生的H+。同理,该思维方式适用于CO2、SO2通入CaCl2或BaCl2溶液。
0.0001mol 0.0001mol 现盐酸不足,故无气体产生。
答案:D
2.Na2CO3溶液中滴加盐酸过程不清楚。
在Na2CO3溶液中滴加HCl,CO32-先转化为HCO3-,再滴加盐酸HCO3-转化为H2CO3,不稳定分解为CO2。
如:在10mL0.01mol/L纯碱溶液中,不断搅拌并逐滴加入1.2mL0.05mol/L盐酸,完全反应后在标准状况下生成二氧化碳的体积为(1998年上海高考题)
A.1.334mL B.2.240mL C.0.672mL D.0mL
思路分析:反应过程为:CO32- HCO3-
HCO3- CO2。
CO2。
盐酸溶液中n(HCl)=0.00006mol,纯碱溶液中n(Na2CO3)=0.0001mol
CO32- + H+ = HCO3-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com