
题目列表(包括答案和解析)
1.反应温度
①4Na+O2(常温)=4Na2O、2Na+O2(加热)= Na2O2;②乙醇+浓硫酸
4.浓硫酸的吸水性和脱水性的区别
|
|
吸水性 |
脱水性 |
|
涵义 |
浓硫酸所具有的吸收游离水的性能。游离水包括空气中的水蒸气及物质中的湿存水。浓硫酸之所以能吸收水,是因它能和水结合成稳定的水合物:H2SO4+nH2O=H2SO4.nH2O(水合物在低温时可析出晶体)。 |
浓硫酸将许多有机物(特别是糖类)中的H、O原子按照水分子中H、O原子个数比夺取出来的性质。 通常讲的浓硫酸腐蚀性即脱水性。 |
|
应用 |
在工厂和实验室是一种理想的干燥剂 |
实验室制CO、CH2=CH2 |
|
注意 |
不能干燥HI、HBr、H2S、NH3等 |
浓硫酸使有机物脱水,不一定都有碳游离出来。 |
[典型例题评析]
例1 导致下列现象的主要原因与排放SO2有关的是(2000年全国高考题)
A.酸雨 B.光化学烟雾 C.臭氧空洞 D.温室效应
思路分析:该题看似简单,实际提出了3个热点概念,因此必须搞清4个概念的内涵,方可做出正确的选择。题中列举的大气环境问题都与化学有密切关系,其中由SO2引发的现象是酸雨。降水时,硫的氧化物以及所形成的硫酸和硫酸盐随着雨雪降到地面,称之为“酸雨”,其发生的主要反应:2SO2+O2 2SO3,SO2+H2O=H2SO3,2H2SO3+O2=H2SO4。溶于雨水中的酸性物质,使雨水中pH在4.5左右。光化学类雾由氮氧化物造成;臭氧空洞主要由氯氟烃、一氧化氮等造成;温室气体主要为二氧化碳等。
2SO3,SO2+H2O=H2SO3,2H2SO3+O2=H2SO4。溶于雨水中的酸性物质,使雨水中pH在4.5左右。光化学类雾由氮氧化物造成;臭氧空洞主要由氯氟烃、一氧化氮等造成;温室气体主要为二氧化碳等。
答案:A
方法要领:这是一道有关环境保护问题的试题,SO2等气体引发酸雨,O3、氮氧化物、有机烃等引发光化学类烟雾,氟利昂、氮氧化物等造成臭氧空洞,CO2气体导致的温室效应。这些导致环境污染的热点问题,复习中应予以重视。
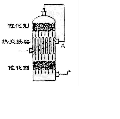 例2 在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见右图)。按此密闭体系中气体的流向,则在A处流出的气体为(1999年上海高考题)
例2 在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见右图)。按此密闭体系中气体的流向,则在A处流出的气体为(1999年上海高考题)
A.SO2 B.SO3 O2 C.SO2 O2 D.SO2 SO3
思路分析:本题是联系生产实际的题目,结合硫酸工业生产,考核学生对工业生产中的热交换原理的理解。
答案:C
方法要领:对教材中工业生产中典型设备的结构(包括进出口方向)、原理及发生的反应必须有足够的重视。通入接触室的气体主要是SO2和O2,经过热交换后从A处流出,然后才能接触催化剂,反应后的气体经过内管又从下口通出。故A处流出的气体仍为SO2和O2。
例3 过氧化氢的沸点比水高,但受热容易分解。某试剂厂制得7%-8%的过氧化氢溶液,再浓缩成30%的溶液时,可采用的适宜方法是(上海市高考题)
A.常压蒸馏 B.减压蒸馏 C.加生石灰常压蒸馏 D.加压蒸馏
思路分析:液态物质的沸点与压强有关,减小压强,能降低其沸点,这样就能在温度不高的情况下使水蒸发而H2O2又不会分解。
答案:B
方法要领:要从混合液中分离出受热易分解的液体物质,一般采用减压蒸馏或减压分馏。防止选A,在常压下蒸馏,H2O2受热分解。
例4 下列反应中,调节反应物用量或浓度不会改变反应产物的是(1998年上海高考题)
A.硫化氢在氧气中燃烧 B.铁在硫蒸气中燃烧
C.二氧化硫通入石灰水 D.硫酸中加入锌粉
思路分析:A中O2少量生成S,O2过量生成SO2;B中产物唯一;C中可生成CaSO4或Ca(HSO4)2;D中浓硫酸生成SO2,稀硫酸生成H2。
答案:B
方法要领:复习中应注意反应条件对产物的影响,与外界条件有关的反应如下:
3.二氧化硫和氯气的漂白性
 SO2和Cl2虽都有漂白性,但漂白原理和现象有不同特点。氯气的漂白原理是由于溶于水生成次氯酸的具有强氧化性,将有色物质氧化成无色物质,褪色后不能恢复原来的颜色。而SO2是由于它溶于水生成的亚硫酸与有色物质直接结合,形成不稳定的无色化合物,褪色后在一定的条件下又能恢复原来的颜色。如:
SO2和Cl2虽都有漂白性,但漂白原理和现象有不同特点。氯气的漂白原理是由于溶于水生成次氯酸的具有强氧化性,将有色物质氧化成无色物质,褪色后不能恢复原来的颜色。而SO2是由于它溶于水生成的亚硫酸与有色物质直接结合,形成不稳定的无色化合物,褪色后在一定的条件下又能恢复原来的颜色。如:
2.熟悉有关各种价态的硫元素性质及转化,以作推断题(主要是框图型)。
牢固掌握各种代表物性质及它们之间的知识网络和反应原理,就可避免死搬硬套。对于框图型等推断题,也要善于找“题眼”,挖掘题中隐含的提示,注意对题设条件的充分应用,尽量缩小范围。推断时不仅要关注网络的结构,还要注意题干提供的不起眼的信息,如颜色、状态、式量、用途等都可能成为突破的切入口。
1.掌握常见物质的俗名、组成、用途,防止张冠李戴。
本章中出现的物质俗名比较多,有些名称之间又特别容易混淆,如冰晶石和重晶石、芒硝和硝石、大苏打和苏打或小苏打等,还有名目繁多的矾盐。这些虽属识记性的知识,但也应做到在理解的基础上进行记忆,注意它们的性质和用途,对记忆其化学组成有帮助。同时要及时归纳和比较,以便清楚地区别它们。
5.检验NH4+离子,可加入烧碱溶液后,必须加热,再用湿润的红色石蕊试纸检验NH3,否则不一定有NH3放出。
[典型例题评析]
例1 Murad等三位教授最早提出NO分子在人体内有独特功能,近年来此领域研究有很大发展,因此这三位教授荣获了1998年诺贝尔医学及生理学奖。下列关于NO的叙述不正确的是(1999年全国高考题)
A.NO可以是某些含低价N物质氧化产物 B.NO不是亚硝酸酐
C.NO可以是某些含高价N物质的还原产物 D.NO是棕色气体
思路分析:本题看似很深奥,实际不然,考查的落点是中学化学常见物质NO的有关性质。根据NO中氮元素的化合价(+2)处于氮元素中间价态,应用氧化还原反应原理可推知:NO既可能是低价含N物质的氧化产物,又可能是高价含N物质的还原产物;根据酸酐概念亚硝酸酸酐应是N2O3;NO应是无色气体。
答案:D
方法要领:要答好这类“高起点,低落点”试题,首先要克服心理障碍,找准题中化学知识运用的着落点,其次,要掌握好重要基本概念和基本理论。这类试题所涉及的基本理论通常是结构理论(包括原子结构中的质量数=中子数+质子数,质子数、核电荷数、核外电子数之间关系等)、分子结构中微粒成键规律、氧化还原反应规律;所涉及的概念通常是原子相对原子质量、同位素、同素异形体等。
 例2 右图为装有活塞的密闭容器,内盛22.4mL一氧化氮。若通入11.2mL氧气(气体体积均在标准状况下测定),保持温度、压强不变,则容器内的密度(1993年上海高考题)
例2 右图为装有活塞的密闭容器,内盛22.4mL一氧化氮。若通入11.2mL氧气(气体体积均在标准状况下测定),保持温度、压强不变,则容器内的密度(1993年上海高考题)
A.等于1.369g/L B.等于2.054g/L.
C.在1.369g/L和2.054g/L之间 D.大于2.054g/L
思路分析:题给的密闭容器中通入O2后发生2个化学反应:2NO+O2=2NO2
 2NO2 N2O4。为便于计算和推导,可将题给22.4mLNO转换为22.4LNO,将题
2NO2 N2O4。为便于计算和推导,可将题给22.4mLNO转换为22.4LNO,将题
给11.2mLO2转换为11.2LO2,即容器内盛有1molNO,充入0.5molO2。根据质量守恒定律,容器内的总质量为:1mol×30g/mol+0.5mol×32g/mol=46g。
 假定1molNO与0.5molO2恰好完全反应,则生成1molNO2。在标准状况下1molNO2的体积为22.4L,此时混合气体的密度为46g/22.4L=2.054g/L。但是,由于反应2NO2 N2O4的存在,且保持温度、压强不变,因此使平衡混合气体的体积小于22.4L,故其密度必定大于2.054g/L。
假定1molNO与0.5molO2恰好完全反应,则生成1molNO2。在标准状况下1molNO2的体积为22.4L,此时混合气体的密度为46g/22.4L=2.054g/L。但是,由于反应2NO2 N2O4的存在,且保持温度、压强不变,因此使平衡混合气体的体积小于22.4L,故其密度必定大于2.054g/L。
答案:D
 方法要领:解本题时最容易忽略2NO2 N2O4的平衡(这是一个隐含的平衡),而误选B。
方法要领:解本题时最容易忽略2NO2 N2O4的平衡(这是一个隐含的平衡),而误选B。
 在涉及到的NO2或N2O4有关量的计算问题,一般要考虑可逆反应2NO2 N2O4的存在对有关量(气体物质的量、体积、密度、式量等)的影响,这是同学们应重视的一个知识点。
在涉及到的NO2或N2O4有关量的计算问题,一般要考虑可逆反应2NO2 N2O4的存在对有关量(气体物质的量、体积、密度、式量等)的影响,这是同学们应重视的一个知识点。
例3 已知磷酸分子 中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换,又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换。又此可推断出H3PO2的分子结构是(1994年全国高考题)
中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换,又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换。又此可推断出H3PO2的分子结构是(1994年全国高考题)

思路分析:由H3PO4在有三个氢原子可以与D2O发生氢交换及题给H3PO2分子结构知:-OH中的H原子能与D2O发生H交换。现H3PO2能与D2O发生H交换而NaH2PO2则不能(说明NaH2PO2分子中没有羟基H原子),可以类推出H3PO2中只有一个-OH,从而选B。
答案:B
方法要领:本题题给信息的实质是:含氧酸分子中的H原子,只有与氧原子结合形成羟基-OH结构时,才有酸性。由于次磷酸H3PO2只能电离出一个H+,它是一元酸;NaH2PO2中的H原子不能电离,也不能与碱反应,NaH2PO2属于正盐。同理CH3COOH分子中只有一个-OH,乙酸是一元酸。因此“含氧酸分子中含有几个H原子,就是几元酸”的说法是错误的。
此题为信息给予题,它以一般学生没有接触过的知识实例作为原型(磷酸分子中3个-OH中的H可D2O发生H交换),要求学生在原型的启发下求解。这类题一般思路为:分析原型→找出规律[只有活泼的氢(能电离的H)才能发生氢交换]→比较问题和原型→建立联系→应用规律→完成迁移。
例4 用以下三种途径来制取相等质量的硝酸铜:(1996年高考化学试测题)
(1)铜跟浓硝酸反应;(2)铜跟稀硝酸反应;(3)铜先跟氧气反应生成氧化铜,氧化铜再跟硝酸反应。以下叙述中正确的是
A.三种途径所消耗的铜的物质的量相等
B.三种途径所消耗的硝酸的物质的量相等
C.所消耗的铜的物质的量是:途径(3)>途径(1)>途径(2)
D.所消耗的硝酸的物质的量是:途径(1)>途径(2)>途径(3)
思路分析:本题是评价制备方案的优劣。从绿色化学角度看(1)要节约原料;(2)是副产品对环境污染小。(1)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,(2)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,(3)2Cu+O2=2CuO,CuO+2HNO3=Cu(NO3)2+H2O。若生成3molCu(NO3)2,可得消耗原料量及生成污染物NOx的量(见下表):
|
|
Cu(NO3)2 |
Cu |
HNO3 |
NOx |
|
(1) |
3mol |
3mol |
12mol |
6mol |
|
(2) |
3mol |
3mol |
8mol |
2mol |
|
(3) |
3mol |
3mol |
6mol |
0mol |
由上表知:(1)耗HNO3最多,生成污染物最多;(3)耗HNO3最少,没有污染物。
答案:A、D
方法要领:本题考查对硝酸性质、用途的理解及氧化还原反应知识,通过分析比较选择出最佳途径的能力。
从不同浓度硝酸与铜的反应可以看出,在硝酸与铜的反应中,硝酸充当了氧化剂和提供硝酸根两种作用,因稀硝酸与铜反应时,氮元素的化合价由+5降为+2价,故作为氧化剂消耗的硝酸较少,而(3)中氧气为氧化剂,硝酸全部用提供酸根用,故消耗硝酸的为(1)>(2)>(3)。
例5 在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。则a和b 分别是(1995年全国高考题)

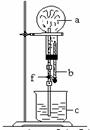
思路分析:产生喷泉的条件:气体在液体中的溶解度很大,产生足够的压强差(负压)。CO2在水中溶解度不大,不能产生喷泉,但在NaOH溶液中因发生CO2+2NaOH=Na2CO3+H2O,其溶解度显著增大,此时形成喷泉。题干要求液体充满烧瓶。
答案:B、D
方法要领:中学阶段,在水中能形成喷泉现象常见的有NH3、HCl、HBr、HI、SO2等溶解度大的气体;CO2、H2S、Cl2等在水中溶解度不大的气体,不能形成喷泉,但若将水改成NaOH溶液,这些气体在碱性溶液中溶解度显著增大,从而形成喷泉;此外,喷泉实验装置若发生改变,也可能使本来不能形成喷泉的气体形成喷泉,因此,要从产生喷泉的条件认识形成喷泉的本质。
例6 同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3,②NO2,进行喷泉实验,经充分反应后,瓶内溶液的物质的量浓度为(1998年上海高考题)
A.①>② B.①<② C.①=② D.不能确定
思路分析:设圆底烧瓶的体积为VL,所含气体的物质的量为xmol。则:
c(NH3)=x/Vmol/L 而3NO2+H2O=2HNO3+NO,c(HNO3)=[2/3xmol]÷[2/3VL]= x/V mol/L。
答案:C
方法要领:只要在同温同压下,单一气体(或某一气体中混有空气)如进行喷泉实验(在H2O中)后所得溶液的浓度均相同。它与液体上升高度无关。如是标准状况则浓度为1/22.4mol/L。
注意:若误以为NO2与H2O生成HNO3的物质的量为2/3x,而忽视了溶液的体积也是2V/3L的话,就会得出两者浓度不等的结论。
 例7 某试剂厂有银(含杂质铜)和硝酸(含杂质Fe3+)反应制取硝酸银.步骤如下(1996年上海高考题)
例7 某试剂厂有银(含杂质铜)和硝酸(含杂质Fe3+)反应制取硝酸银.步骤如下(1996年上海高考题)
依据上述步骤,完成下列填空:
(1)溶解银的硝酸应该用 硝酸(填浓或稀)。原因是 (填序号,下同)
(a)减少过程中产生NOX的量 (b)减少原料银的消耗量 (c)节省硝酸物质的量
(2)步骤B加热保温的作用是 .
(a)有利于加快反应速率
(b)有利于未反应的硝酸挥发
(c)有利于硝酸充分反应,降低溶液中[H+]
(3)步骤C中是为了除去Fe3+、Cu2+等杂质,冲稀静置时发生的化学反应是
(a)置换反应 (b)水解反应 (c)氧化还原反应
产生的沉淀物化学式 .
思路分析:(1)根据反应方程式:Ag+2 HNO3(浓)=AgNO3+NO2↑+H2O、3Ag+4HNO3(稀)=3AgNO3+NO↑+2H2O可知:每生成1molAgNO3,如用浓HNO3,消耗HNO32mol,产生1molNO2;如用稀HNO3,只需HNO34/3mol,放出NO1/3mol。故用稀硝酸比用浓硝酸好,原因为(a)、(c)。
(2)根据温度对反应速率的影响,加热保温是使反应加快,促使HNO3与Ag反应,而不希望HNO3损失,因此其目的是(a)、(c)。
(3)由水解原理,溶液浓度小,促进水解,使Fe3+、Cu2+生成难溶的Fe(OH)3、Cu(OH)2而除去。
答案:(1)稀,(a)、(c) (2)(a)、(c) (3)(b),Fe(OH)3、Cu(OH)2
4.NO3-在酸性溶液中具有强氧化性,可以将Fe2+氧化为Fe3+、SO32-氧化为SO42-,将I-、Br-、S2-氧化为I2、Br2、S。
3.氮可以形成多种氧化物。NO2可以与水反应生成硝酸,但NO2不是硝酸的酸酐。掌握酸酐的判断方法。NO2与溴蒸气不能用湿润的KI淀粉试纸检验。
2.NO、O2被水吸收的分析错误。
NO、O2被水吸收实质上发生如下反应:2NO+O2=2NO2,3NO2+2H2O=2HNO3+NO。生成NO还可以继续氧化,生成NO2再溶于水,这是一个循环反应。如无任何气体剩余,最终产物应为HNO3,恰好反应的量的关系:4NO+3O2+2H2O=4HNO3,实际反应中可以有NO或O2剩余,但不能两者兼有之。
1.氨水显弱碱性的理解不全面。
氨气溶于水形成氨水,氨水少部分电离出OH-、NH4+,所以氨水具有弱碱性。注意以下两点:
(1)氨水遇Al3+、Fe3+、Mg2+分别可以生成Al(OH)3、Fe(OH)3、Mg(OH)2沉淀,但氨水中滴加Ag+溶液开始出现沉淀AgOH,继续滴加沉淀即溶解生成银氨溶液;(2)氨水遇酸、酸性氧化物可以成盐,又根据氨水与酸的量关系分别得到正盐和酸式盐。如:用氨水吸收少量二氧化硫的离子方程式 NH3.H2O+SO2=NH4++HSO3-是错误的。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com