
题目列表(包括答案和解析)
1、走一条可持续发展的道路,是我国社会经济保持长期稳定、健康发展的必然选择。下列举措中有背于这一指导思想的是( )
A、加大开发太阳能、水能、风能、地热能等能源力度,减少化石燃料的使用
B、研制乙醇汽油(汽油中添加一定比例的乙醇)技术,降低机动车辆尾气中有害气体排放
C、生产、生活中,努力实现资源的循环利用
D、利用高新技术,提高石油、煤、天然气产量,以满足工业生产快速发展的需求
31.将KOH和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体。当生成沉淀的质量刚好最大时,消耗CO2的体积为224mL(标准状况,忽略CO2溶于水情况。以下情况相同。)
(1)生成沉淀的质量刚好最大时,反应的方程式为: 。
(2)原混合物中Ca(OH)2的质量为 g。
(3)沉淀恰好溶解时,消耗CO2的体积为 mL
(4)写出溶液中生成沉淀的质量m(g)与通入CO2的体积V(mL)之间的函数表达式。
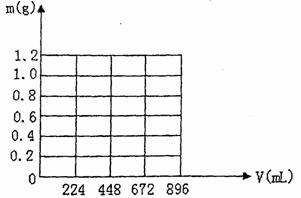 (5)在图示坐标系上,画出生成沉淀的质量m(g)与通入CO2的体积V(mL)的关系曲线。
(5)在图示坐标系上,画出生成沉淀的质量m(g)与通入CO2的体积V(mL)的关系曲线。
30.将0.03mol的硫酸铁和硫酸亚铁的混合物溶于水中,加入25.0mL 4.00mol/L氢氧化钠溶液,恰好完全反应,再放置一段时间。求:
(1)原混合液中硫酸铁、硫酸亚铁的质量
(2)最后能得到的沉淀的质量
29.已知烯烃在一定条件下可发生下列反应:

R-CH=CH-R′ R-CHO+R′-CHO
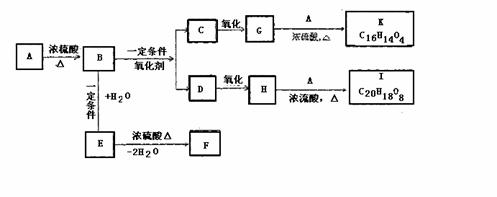 物质A的分子式为C9H10O3,在一定条件下可发生下列转换,其中A、E互为同分异构体,且都能与碳酸钠反应产生二氧化碳;F是含有三个六元环的化合物,K、I是酯化反应的产物。
物质A的分子式为C9H10O3,在一定条件下可发生下列转换,其中A、E互为同分异构体,且都能与碳酸钠反应产生二氧化碳;F是含有三个六元环的化合物,K、I是酯化反应的产物。
(1)写出A、B、C、D、E、F的结构简式
A 、 B 、C 、D 、D 、F
(2)写出H→I化学方程式:
(3)A的一种同分异构体不能和碳酸钠反应,1molA与足量的金属钠反应,产生标况下11.2L氢气,请写出符合条件的A的一种结构简式 。
28.在某工厂在生产维尼纶过程中,先以乙炔和醋酸为原料,通过以下反应制各中间体。
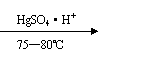
CH≡CH+CH3COOH CH3COOH=CH2
(1)以上反应类型是 ,中间体名称是 。
(2)写出中间体通过碳碳双键由小分子变成大分子的反应方程式
。
(3)将中间华体和稀碱溶液共热,可蒸馏出一种有机物甲的水溶液,含2.2g甲的溶液进行银镜反应可得10.8g银,甲的结构简式 。
注意:25为分叉题,分A、B两题,考生可任选一题。若两题均做,一律按A题记分,A题适合使用二期课改新材料的学生解答,B题适合使用一期课改教材的考生解答。
26.(A)某学生做元素性质递变实验时自己设计了一套方案,并记录了有关实验现象如下表
|
实验方案 |
实验现象 |
|
1.用砂纸打磨后的镁带与水反应,再向反应后溶液中滴加酚酞 |
(A) |
|
2.向新制的氢硫酸饱和溶液中滴加新制的氯水 |
(B)产生气体,可在空气中燃烧,溶液变成浅红色 |
|
3.钠与滴有酚酞的试液的冷水反应 |
(C)反应不十分强烈,产生的气体可在空气中燃烧 |
|
4.镁带与2mol/L的盐酸反应 |
(D)剧烈反应,产生可燃性气体 |
|
5.铝条与2mol/L的盐酸反应 |
(E)生成白色胶状沉淀,然后沉淀消失 |
|
6.向氢化铝溶液中滴加氢氧化钠溶液至过量 |
(F)生成黄色沉淀 |
请你帮助该同学完成实验报告:
(1)实验的目的 。
(2)实验仪器:① ② ③ ④试管夹⑤镊子⑥小刀⑦玻璃片⑧砂纸等
(3)实验内容:
与实验方案1-6对应的实验现象依次为 (填:字母编号)。
实验现象(A)为: 。
 (4)实验结论
。
(4)实验结论
。
25.醋酸是重要的一元酸,在有机和无机反应中都有应用。
(1)在酯化反应的实验中,乙酸、乙醇的用量和平衡时乙酸乙酯的生成量如下表
|
反应 |
乙醇(kmol) |
乙酸(kmol) |
乙酸乙酯(kmol) |
|
1 |
2 |
2 |
1.33 |
|
2 |
3 |
2 |
1.57 |
|
3 |
4 |
2 |
X |
|
4 |
5 |
2 |
1.76 |
①该酯化反应的平衡常数K的表达式为:K=
②由表中数据推测,数值X的范围是 推断的依据为
 ③假设乙醇的价格为500/k mol,乙酸乙酯的价格为1600元/kmol,同反应2相比,反应3的经济效益
(填:增加或减少)
③假设乙醇的价格为500/k mol,乙酸乙酯的价格为1600元/kmol,同反应2相比,反应3的经济效益
(填:增加或减少)
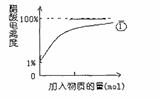
(2)10mL 0.10mol/L的稀醋酸中存在着平衡:CH3COOH CH3COO-+H+。①向稀醋酸中不断加水②向稀醋酸中慢慢滴加0.10mol/L的稀氢氧化钠溶液。①中醋酸电离度的变化图线已画出,请你在下图中画出②过程中醋酸电离度的变化图线
24.K2Cr2O7和H2O2在H2SO4溶液中混合时,可以看到下面两个现象:
(1)混合后5s-10s内,溶液由橙色变暗蓝色;
(2)在80s -160s内由暗蓝色变为绿色,与此同时,放出气泡。
与之相对应的两个方程式为:
A:Cr2O72‑+H2O2→CrO5+H2O
 B:CrO5+H+→Cr3++O2↑
B:CrO5+H+→Cr3++O2↑
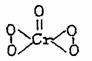
CrO5的结构式为
(1)指出A、B是否属于氧化原还反应。
(2)配平A、B反应组成的总反应方程式,并标出反应的电子转移方向和数目。
(3)若反应中生成O211.2L(标准状况),H2O2 (填:得到或失去)电子的数目为 个。
23.(B)元素周期表是学习化学的重要工具,它饮食许多信息和规律。下表所列是五种短周期的原子半径及主要化合价:
|
元素代号 |
A |
B |
C |
D |
E |
|
原子半径/m |
0.16 |
0.143 |
0.102 |
0.089 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6,-2 |
+2 |
-2 |
(1)用元素代号标出它们的周期表中对应位置
(2)在上面的元素周期表中通常寻找催化剂材料的区域,用粗线标出。
(3)五种元素中非金属性最强的是 (填元素符号),C、E形成化合物为 (填化学式)
(4)证明B元素与A元素在性质上有明显不同的离子方程式为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com