
题目列表(包括答案和解析)
18.(8分)工业甲醇的质量分数可以用下列方法测定:
①在稀H2SO4中甲醇被Cr2O72-氧化成CO2和H2O,反应式为:
CH3OH+Cr2O72-+8H+=CO2↑+2Cr3++6H2O;
②过量的Cr2O72-可用Fe2+与之完全反应:
_____Cr2O72-+_____Fe2++_____H+ --_____Cr3++______Fe3++______H2O
现有0.12 g工业甲醇,在H2SO4溶液中与25 mL 0.2 mol·L-1K2Cr2O7溶液反应,多余的K2Cr2O7再用1 mol·L-1FeSO4与其反应,结果用去FeSO4溶液9.6 mL。
⑴配平第②步中离子方程式。 ⑵工业甲醇的质量分数为 。
17.(8分)下列说法中,正确的是(填序号)_____________
A AgCl+NaBr=AgBr+NaCl能在水中进行,是因为AgBr比AgCl更难溶于水
B 用渗析法分离淀粉中混有的氯化银杂质 C 可以用分液漏斗将甘油和水的混合液体分离 D 用碱式滴定管量取20.00毫升高锰酸钾溶液
E 配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止 F 在氢氧化铁胶体中加入少量硫酸会产生沉淀
G硝酸银溶液通常保存在棕色的试剂瓶中,是因为硝酸银见光易分解
16.下列离子反应方程式正确的是
A.澄清石灰水来吸收氯气:Cl2+OH-=Cl-+ClO-+H+
B.将金属Na加入冷水中:2Na+2H2O=2Na++2OH-+H2↑
C.向稀硝酸中加入少量铁粉:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
D.在碳酸氢钙溶液中加入少量苛性钾溶液:
Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
 08届高三化学上学期第二次质量检测试题
08届高三化学上学期第二次质量检测试题
第Ⅱ卷(非选择题,共48分)
请同学们把1-16答案填入下表:
15. 下列各组离子能在指定溶液中,大量共存的是 :
①无色溶液中:K+,Cu2+,Na+,MnO4-,SO42-
②使pH=11的溶液中:CO32-,Na+,AlO2-,NO3-
③加入Al能放出H2的溶液中:Cl-,HCO3-,NO3-,NH4+
④加入Mg能放出H2的溶液中: NH4+,Cl-,K+,SO42-
⑤使石蕊变红的溶液中:Fe3+,MnO4-,NO3-,Na+,SO42-
⑥酸性溶液中:Fe2+,Al3+,NO3-,I-,Cl-
A ①②⑤ B ①③⑥ C ②④⑤ D ①②④
14.在海水中提取溴的反应原理是5NaBr+NaBrO+3H2SO4=3Br2 +3Na2SO4+ 3H2O下列反应的原理与上述反应最相似的是 :
A. 2NaBr+Cl2=2NaCl+Br2
B.2FeCl3+H2S=2FeCl2+S+2HCl
C. 2H2S+SO2=3S+2H2O
D.AlCl3+3NaAlO3+6H2O=4Al(OH)3+3NaCl
13. ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是:
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是:
A.KClO3在反应中得到电子 B.ClO2是氧化产物
C.H2C2O4在反应中被还原 D.1mol KClO3参加反应有2 mol电子转移
12.某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合液,经测定ClO-和ClO3-个数比为1:2,则Cl2与KOH溶液反应时,被还原的氯与被氧化的氯的物质的量之比为( )
A.21:5 B.4:1 C.3:l D.11:3
11.下列有关溶液性质的叙述,正确的是
A.室温时饱和的二氧化碳水溶液,冷却到0℃时会放出一些二氧化碳气体
B.强电解质在水中溶解度一定大于弱电解质
C.相同温度下,把水面上的空气换成相同压力的纯氧,100g水中溶入氧气的质量增加
D.将40℃的饱和硫酸铜溶液升温至50℃,或者温度仍保持在40℃并加入少量无水硫酸铜,在这两种情况下溶液中溶质的质量分数均保持不变。
10.有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)/mol·L-1为
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
9. 在标准状况下,A L NH3溶于B mL水中,得到密度为ρg/cm3的R L氨水,则此氨水的物质的量浓度是
(A)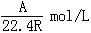 (B)
(B)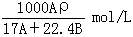
(C)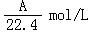 (D)
(D)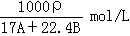
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com