
题目列表(包括答案和解析)
19.某化学兴趣小组用回收的镁铝合金制取氢气。现有l0.8 g镁铝合金,下列说法正确的是
A.常温下与足量18mol/LH2SO4溶液反应,最多可放出0.6 mol H2
B.常温下与足量2mol/LHNO3溶液反应,最少可放出0.45 mol H2
C.常温下与足量2 mol/L H2SO4溶液反应,放出H2的物质的量在0.45 mol-0.6 mol之间
D.常温下与足量2mol/LNaOH溶液反应,放出H2的物质的量在0.45 mol-0.6 mol之间
18. 某氧化物不溶于水,溶于熔化的NaOH中,生成易溶于水的化合物,向稀盐酸中滴加所生成化合物的水溶液,立即有白色沉淀产生,则原氧化物是( )
A.Al2O3 B.MgO C.SiO2 D.P2O5
17.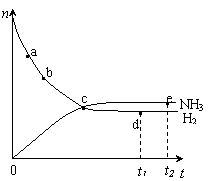 对于密闭容器中的反应:N2(g)+3H2(g)
对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g);△H <0,在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g);△H <0,在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
A.点a处的正反应速率比点b处的大
B.点 c处的正反应速率比逆反应速率大
C.点d (t1时刻) 的n(N2)比点 e (t2时刻) 处的n(N2)大
D.其他条件不变,773K下反应至t1时刻,此时画出的两根平行线间的距离将要变大
16. 下图是一水溶液在pH从 0至14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的组成百分率,下列叙述正确的是

A .此图可完全根据1.0 mol/LHCl溶液滴定1.0mol/L碳酸钠溶液的实验数据绘出
B. 1.0 mol/LHCl溶液滴定1.0mol/L碳酸钠溶液恰好反应时呈中性
C. 二氧化碳溶液在血液中多以HCO3-的形式存在
D. 在pH为6.37及10.25时,溶液中[H2CO3]=[HCO3-]=[CO32-]
15.下列有关实验的叙述正确的是
A.浓硝酸可保存在带橡皮塞的棕色细口瓶中
B.用pH试纸测定溶液pH时,pH试纸不应事先润湿
C.配制一定物质的浓度的溶液时,选用的容量瓶规格由需配制的溶液体积决定
D.中和滴定时为了使滴定终点溶液颜色变化明显,可多滴几滴指示剂
14.含有2-5个碳原子的直链烷烃沸点和燃烧热的数据见下表:
|
烷烃名称 |
乙烷 |
丙烷 |
丁烷 |
戊烷 |
|
沸点(℃) |
-88.6 |
-42.1 |
-0.5 |
36.1 |
|
燃烧热(kJ·mol-1) |
1560.7 |
2219.2 |
2877.6 |
3535.6 |
根据表中数据,下列判断错误的是( )
A.正庚烷在常温常压下肯定不是气体
B.烷烃燃烧热和其所含碳原子数成线性关系
C.随碳原子数增加,烷烃沸点逐渐升高
D.随碳原子数增加,烷烃沸点和燃烧热都成比例增加
13.MnO2和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO2和Zn的基本步骤为:
⑴ 软锰矿、闪锌矿与硫酸共热: MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O。
⑵ 除去反应混合物中的不溶物
⑶ 电解混合液MnSO4+ZnSO4+2H2O MnO2+Zn+2H2SO4
下列说法不正确的是
A.步骤⑴中MnO2和H2SO4都是氧化剂
B.步骤⑴中每析出12.8g S沉淀共转移0.8mol电子
C.电解时MnO2在阳极处产生
D.硫酸在生产中可循环使用
12.常温下,下列溶液中一定能大量共存的离子组是
A.含有大量S2-的溶液:ClO-、Na+、Cl-、CO32-
B.无色澄清溶液:MnO4-、SO42-、K+、Fe3+
C.能使pH试纸变红的溶液:NH4+、Na+、SO42-、Fe3+
D.水电离产生的c(H+)=1×10-12mol/L的溶液:HCO3-、NH4+、Cl-、Ca2+
11.短周期元素A、B、C的原子序数依次递增,它们的原子最外层电子数之和为10,A与C同主族,B原子的最外层电子数等于A原子的次外层电子数,则下列叙述正确的是
A.原子半径:A<B<C
B.A的氢化物稳定性大于C的氢化物稳定性
C.三种元素的最高价氧化物对应水化物均可由化合反应得到
D.高温下,A单质能置换出C单质
10、向一定量的Fe、FeO和Fe2O3的混合物中加入120 mL 4 mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
A.0.24 mol B.0.21mol C.0.16 mol D.0.14 mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com