
题目列表(包括答案和解析)
29.A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为____;
(2)B元素的负一价离子的电子层结构与氩相同,C元素的正一价离子的电子层结构与氙相同,B、C形成的化合物的化学式为 ;其晶体内每个B离子周围有 个C离子与之紧相邻。其晶体的主要物理性质有: _____ _(写出两条即可)。
(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为_____,其基态原子的电子排布式为____________________。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其单质在一定条件下能与硫(S)反应,试写出该反应方程式 _______________________。
 第一次六校联考
第一次六校联考
28.2005年诺贝尔化学奖授予了三位科学家,以表彰他们在烯烃复分解反应研究方面所取得的成绩。已知烯烃的交叉复分解反应机理为双键断裂,换位连接。如:
CH2=CHR1+CH2=CHR2 CH2=CH2+R1CH=CHR2
CH2=CH2+R1CH=CHR2
|
 又已知:①R-CH2-CH=CH2+Cl2
R-CHCl–CH=CH2+HCl
又已知:①R-CH2-CH=CH2+Cl2
R-CHCl–CH=CH2+HCl
②F是油脂水解产物之一,能与水任意比互溶;K是一种塑料;I的分子式为C9H14O6
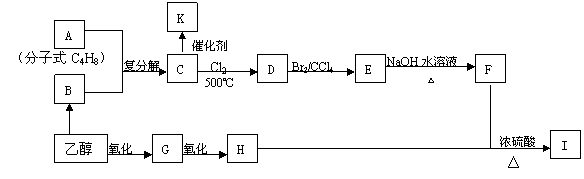

请回答下列问题:
(1)C4H8属于烯烃的同分异构体有 种;
(2)分子式为C4H8的所有烯烃通过烯烃复分解反应后生成的C5H10有 种结构
(3)请写出物质I的结构简式: ;
(4)写出下列反应方程式:C→D:
(5)K中的链节是 ;K属于 (线型、体型)结构
27.由乙烯和其他无机原料合成环状化合物其合成过程如下(水及其他无机产物均已省略):


请分析后回答下列问题:
(1)反应的类型分别是①___________、②________________;
(2)D物质中的官能团为___________________________;
(3)C物质的结构简式___________________,物质X与A互为同分异构体,则X的结构简式为_________________,X的名称为_______________________________;
(4)B、D在一定条件下除能生成环状化合物E外,还可反应生成一种高分子化合物,试写出B、D反应生成该高分子化合物的方程式_________________________。
26. (10分)锶(Sr)位于元素周期表的第5周期ⅡA族。碳酸锶大量用于生产彩色电视显像管的荧光屏玻璃。工业上常以天青石(主要成分为硫酸锶,含不溶性杂质)为原料,采用以下两种方法制取碳酸锶,进而制得多种锶的化合物。
方法一:将天青石粉碎后在1000℃-1200℃时与碳在还原气氛中反应制得硫化锶。向硫化锶溶液中通人CO2得到碳酸锶。
方法二:将天青石粉末与碳酸钠溶液的混合物在90℃时加热l-2 h,经过滤、洗涤,得到碳酸锶。
(1)方法一将天青石粉碎的目的是__________________ 。写出用碳还原天青石反应的化学方程式:_____________________________________。
(2)方法二的反应能够发生,说明______________ 。为了使该反应充分进行,还可以采取的措施是__________。
(3)两种方法中得到的碳酸锶纯度较高的是_______________(填“方法一”或“方法二”),理由是______________________________________________。
(4)下列关于锶及其化合物的叙述中,正确的是___________。
A.离子半径:Ba2+>Sr2+>Ca2+ >Be2+ B.碱性:Ba(OH)2>Sr(OH)2>Ca(OH)2
C.SrCO3高温分解可以制取SrO D.SrCO3与HNO3溶液反应可制取Sr(NO3)2
25.(10分)二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
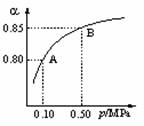 (1)硫酸生产中,SO2催化氧化生成SO3: 2SO2(g)+O2(g)
(1)硫酸生产中,SO2催化氧化生成SO3: 2SO2(g)+O2(g) 2SO3(g)。某温度下,SO2的平衡转化率(a )与体系总压强(p)的关系如图所示。根据图示回答下列问题:
2SO3(g)。某温度下,SO2的平衡转化率(a )与体系总压强(p)的关系如图所示。根据图示回答下列问题:
①将2.0 mol SO2和1.0 mol O2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。该反应的平衡常数等于____________。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g);DH =-574 kJ/mol
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g);DH =-1160 kJ/mol
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为_____________(阿伏加德罗常数的值用NA表示),放出的热量为_________kJ。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M = Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
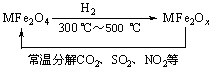
请写出MFe2Ox分解SO2的化学方程式______________________________________(不必配平)。
24.(12分)某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
|
实验步骤 |
实验现象 |
|
将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
|
反应结束后分离出溶液备用 |
|
|
红色固体用蒸馏水洗涤后,置于潮湿空气中 |
一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应:____________________________________;
化合反应:____________________________________。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是_________________________________________。解释此现象的离子方程式是_____________________________________
_________________________________________。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰。
①用铝与软锰矿冶炼锰的原理是(用化学方程式表示)________________________________________________。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是______________________________________。
23.(13分)某学校化学兴趣小组同学在两支小试管中分别加入浓度为4mol/L稀盐酸3mL,将分别装有0.3gNaHCO3和0.3gNa2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3和Na2CO3同时倒人试管中,观察到的现象及分析如下:
(1)比较两支试管中的现象: 。
(2)若两气球内的压强相同.两试管大小相同,则大小气球体积之比约为 (填最简整数比)
(3)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。甲同学写出了下列热化学方程式(其中“aq”代表水合或无限稀释的含义):
HCO3-(aq)+H+(aq)=H2O(1)+CO2(g);△H>O;
CO32-(aq)+2H+(aq)=H2O(1)+CO2(g);△H<O;
甲分析结论的方法是否科学? 。(填“是”或“否”)
|
序 号 |
试剂l |
试剂2 |
混合前温度 |
混合后最高或最低温度 |
|
1 |
35mL水 |
2.5gNaHCO3固体 |
20℃ |
18.5℃ |
|
2 |
35mL水 |
3.2gNa2CO3固体 |
20℃ |
24.3℃ |
|
3 |
35mL稀盐酸 |
含2.5g NaHCO3
的饱和溶液32.5ml |
20℃ |
19℃ |
|
4 |
35mL稀盐酸 |
含3.2g Na2CO3的饱和溶23.1mL+10mL水 |
20℃ |
24.2℃ |
|
5 |
35mL稀盐酸 |
2.5g NaHCO3固体 |
20℃ |
16.2℃ |
|
6 |
35mL稀盐酸 |
3.2gNa2CO3固体 |
20℃ |
25.1℃ |
(4)为研究反应是吸热还是放热,乙同学继续进行下列实验。(每个实验平行做三次,取平均值)
请你帮助填写相关内容:
①该研究报告的题目是《 》
②通过上述实验可得出五条结论:
a.NaHCO3的溶解是 (“吸热”或“放热”)过程;
b.Na2CO3的溶解是 (“吸热”或“放热”)过程;
c.NaHCO3的饱和溶液和盐酸的反应是 (”吸热”或“放热”)反应;
d.Na2CO3的饱和溶液和盐酸的反应是 (“吸热”或“放热”)反应;
e.NaHCO3固体与稀盐酸反应的反应热是 (填a→d的字母)的热效应之和。
22.(11分)晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
 ①高温下用碳还原二氧化硅制得粗硅
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl SiHCl3+H2
③SiHCl3与过量H2在1000-1100 ℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为: 。
(2)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):

①装置B中的试剂是 ,装置C中的烧瓶需要加热,其目的是: 。
②装置D中发生反应的化学方程式为 ,装置D不能采用普通玻璃管的原因是 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
④为鉴定产品硅中是否含微量铁单质,请设计实验进行检验,在答题卡相应位置叙述实验操作、预期现象和结论。
21. (6分)实验室有一份混有少量碳酸钙杂质的碳酸钡样品。分离并提纯碳酸钡的实验步骤如下,请根据要求填空(下图为Ba(OH)2和Ca(OH)2的溶解度曲线):
(6分)实验室有一份混有少量碳酸钙杂质的碳酸钡样品。分离并提纯碳酸钡的实验步骤如下,请根据要求填空(下图为Ba(OH)2和Ca(OH)2的溶解度曲线):
⑴ 高温灼烧碳酸钡和碳酸钙的混合物,直至分解分解。所需仪器除坩埚、泥三角、玻璃棒、三脚架外还有 ;
⑵ 将灼烧后的固体混合物置于80℃的热水中,制成氢氧化钡的热饱和溶液。为减少Ba(OH)2的损失并除去不溶物应进行的操作是 ;
⑶ 将“⑵”中滤液 并过滤,得到的Ba(OH)2固体溶于水制成溶液。
⑷ 向制得的Ba(OH)2溶液中滴加 (填一种试剂名称),再通入二氧化 碳。当观察到 时,即可停止通二氧化碳。
⑸ 滤出碳酸钡沉淀,经洗涤、干燥后即得到纯净的碳酸钡。
20.常温下,下列有关叙述正确的是
A.Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
B.NaB溶液的pH=8,c(Na+)-c(B-)=0.99×10-6mol/L
C.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序①=②>③
D.10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20mL
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com