
题目列表(包括答案和解析)
22.(12分)B、C、D均为中学化学常见的物质,它们之间的反应关系如下图:
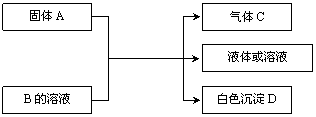
回答下列问题:
(1)若A是可溶性的强碱,B是酸式盐,D不溶于稀硝酸,则B的化学式为________________,有关的离子方程式为____________________________________________________。
(2)若B是正盐,D既可溶于盐酸又可溶于NaOH溶液。
① 若C为能使澄清石灰水变浑浊的无色无味气体,该反应的离子方程式为____________________________________________________。
② 若A是一种淡黄色固体,且A与B以物质的量之比3∶1混合时,推知B的化学式为__________。
(3)若B为Ca(HCO3)2溶液,A与B的溶液反应时只生成气体C、CaCO3和水,则A的化学式为__________________。
21.(17分)硫酸铜的制备实验是无机化学实验教学中一个必做实验,某研究性学习小组设计了如下两个实验方案:
实验一:
因铜不能与稀硫酸直接反应,实验中以浓硝酸分次加入到铜和稀硫酸的混合液中,加热使之完全反应,通过蒸发、析晶等操作得到硫酸铜晶体。
(1)浓硝酸所起的作用是___________________________________
(2)该反应的原理是(用化学方程式表示)_______________________________________________。
(3)为了吸收反应产生的尾气,设计了下列尾气的处理装置,其中合理的是_______________(填装置序号),选择的吸收液是_________________(填序号)。
供选择的装置:

供选择的吸收液:
A 、浓H2SO4 B、H2O C、NaOH D、饱和食盐水
实验二:
以空气为氧化剂的一步氧化法,将空气或氧气直接通入到铜粉与稀硫酸的混合物中,其反应原理为2Cu + O2 + 2H2SO4 = 2CuSO4 + 2H2O ,但反应速率太小,当升高温度到80-90℃,反应仍然缓慢。如在铜粉和稀硫酸的混合物中加入少量Fe2(SO4)3溶液,则速率明显加快。
(4)用离子方程式表示速率明显加快的原理_______________________________________________。Fe2(SO4)3的作用是___________________________。
(5)得到的混合液用______________调节pH =2-4,使Fe3+形成Fe(OH)3沉淀而除去,且Fe(OH)3可以循环使用。
(6)请根据以上内容,对这两个实验方案进行评价,填下表:
|
|
实 验 一 |
实 验 二 |
|
主要优 点 |
|
|
|
主要缺 点 |
|
|
20.(6分)请从下列a-g仪器中选择适当的仪器填空(填编号)。
(1) 开始时液面在a mL处,继续添加液体至液面在b mL处,则所加液体体积为(a-b)mL的是________________。
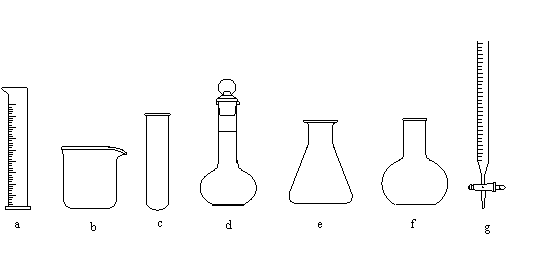 (2) 仪器上标明了使用温度的是________________。
(2) 仪器上标明了使用温度的是________________。
(3) 用8.2 mL的浓盐酸配制一定物质的量浓度的稀盐酸,不可缺少的仪器是________________。
19.下列说法或表示法正确的是
A.若将等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(石墨)-→C(金刚石);△H= +119 kJ / mol ”可知,金刚石比石墨稳定
C.在稀溶液中: H++OH-=H2O;△H=-57.3 kJ / mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g) = 2H2O(l);△H = +285.8 kJ / mol
18.对于反应2SO2 + O2
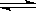 2SO3,下列判断错误的是
2SO3,下列判断错误的是
A.2体积SO2和足量O2反应,必定生成2体积SO3
B.其他条件不变,增大压强,平衡必定向右移动
C.平衡时,SO2消耗速率必定等于O2生成速率的两倍
D.单位时间内每生成1 mol SO2,同时消耗1.5 mol O2,则反应必逆向进行
17.室温时某溶液的pH值为1,该溶液中可能大量共存的离子组是
A.Zn2+、Cl-、Ba2+、NO3- B.Cu2+、NO3-、Al3+、SO42-
C.K+、SO42-、Na+、AlO2- D.Na+、NO3-、K+、CO32-
16.短周期元素x、y、z在周期表中的位置关系如右图所示:
|
|
|
x |
|
|
y |
|
|
z |
|
|
以下的叙述中正确的是
A.z一定是活泼金属元素
B.x的最高氧化物的水化物是一种强酸
C.1 mol y的单质跟足量水反应时,发生转移的电子有2 mol
D.由z单质形成的晶体属于分子晶体
15.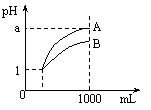 室温下,pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000mL,其pH值与溶液体积的关系如图,下列说法正确的是
室温下,pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000mL,其pH值与溶液体积的关系如图,下列说法正确的是
A.A、B两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液强;
C.若a = 4,则A是强酸,B是弱酸;
D.稀释后,a可能大于4。
14.液氯是一种重要的化工原料,在运输和储存中应注意安全。去年3月29 日,京沪高速公路淮安段发生一起严重交通事故,使槽罐车中32 t液氯快速泄漏,造成人员伤亡、大片农田被毁的严重事故。对于在事故发生时的下列各种应急处理,你认为正确的是
A.附近居民切忌惊慌,用毛巾护住口鼻,朝顺风方向逃逸或向避风的沟塘低洼处转移
B.要快速地将翻落的氯槽罐安全起吊移至水池,进行碱液稀释中和
C.液氯的流淌速度很慢,居民不必惊慌,可以放心地撤退到家中,关紧门窗
D.检修或现场抢救时,如果没有防毒面具,可以佩戴用浓的烧碱溶液浸泡过的湿口罩
13.目前人们正在研究一种高能电池--钠硫电池,它是以熔融的钠、硫为两极,以Na+导电的β-Al2O3陶瓷作固体电解质,反应式如下:2Na + xS Na2Sx,以下说法正确的是:
Na2Sx,以下说法正确的是:
A.放电时钠作正极,硫作负极;
B.放电时钠极发生还原反应
C.充电时,阳极发生的反应为:Sx2--2e = x S
D.充电时钠极与外电源的正极相连,硫与外电源的负极相连
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com