
题目列表(包括答案和解析)
21、(9分)下列框图中的A-J是中学化学中常见的八种物质,所有物质均由短周期元素组
成,已知常温、常压下D为无色液体, C、E、G均为气体单质,B为金属,I是由3个原
子组成的一元含氧弱酸分子, A-J可发生如下转化:
|
|

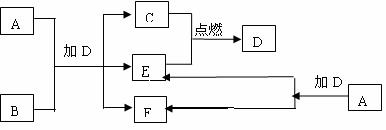
请填写下列空白:
(1)G的名称为 ,F的电子式为 。
(2)15.6gA与D完全反应,转移的电子的物质的量为 。
(3)常温下,A为一种 色的固体,它的一种重要用途是
。
(4)写出D、G反应转化为I和J的离子方程式 。
08届高三第二次月考
20、(12分)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。
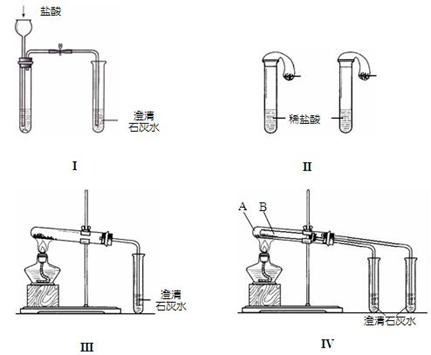
(1) 只根据图I、II所示实验,能够达到实验目的是(填装置序号)__________________; (2)图III、IV所示实验均能鉴别这两种物质,其反应的化学方程式为
______________________________
;与实验III相比,实验IV的优点是(填选项序号)___________________;
A、IV比III复杂
B、IV比III安全
C、IV比III操作简便
D、IV可以做到用一套装置同时进行两个对比实验,而III不行
(3)若用实验IV验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是___________________;
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。
①当石灰水过量时,其离子方程式为___________________ ;
②当碳酸氢钠与氢氧化钙物质的量之比为2 : 1时,所得溶液中溶质的化学式为___________________,请设计实验检验所得溶液中溶质的阴离子。
_____________________________________________________________________________________ 。
19、(14分)已知A、B、C、D、E为五种短周期不同主族的元素,其原子序数依次递增。A、E两种原子最外层电子数之和是B原子最外层电子数的2倍;C、E两种原子最外层电子数之和是D原子最外层电子数的2倍。A、E形成的化合物分子甲中电子总数为18,D是地壳中含量最多的元素。回答下列的问题。
(1)甲的电子式为 ,其分子为 分子(填“极性”或“非极性”)
(2)工业生产E元素的单质的化学方程式为 。
(3)A单质与C单质在一定条件下可化合为乙,工业生产乙的条件为 ,室温下,向pH=a的乙的水溶液中加入等体积pH=b的甲的水溶液,且a+b=14,充分作用后,溶液pH 7(填“>”“<”或“=”),该溶液中各种离子浓度由大到小的顺序为 。
(4)C、D两元素可形成多种化合物,其中某一化合物含C元素质量分数为46.67%,写出该化合物的化学式 ,将它转化为C的最高价含氧酸的化学方程式为 。
(5)A、B两元素也可形成多种化合物,其中分子量最小的分子为丙,则丙的空间构型为 。用D的单质和丙可以制成原电池,电池中装有浓KOH溶液,用多孔的惰性电极浸入浓KOH溶液 在X极通入化合物丙,Y极通入D的单质,则X极是该电池的 极,X极的电极反应式为 。
18、(8分)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是___________________。
(2)该反应中,发生还原反应的过程是_________→______________。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目___________________________________________________________。
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为_____________________________________。
17、(5分)铁路提速为鲜活水产品、新鲜水果和蔬菜的运输提供了有利条件。在鲜活鱼的长途运输中,必须考虑以下几点:水中需要保持适量的O2;及时除去鱼排出的CO2;防止细菌的大量繁殖。现有两种在水中能起供氧灭菌作用的物质,其性能如下:
过氧化钠(Na2O2):易溶于水,与水反应生成NaOH和O2;
过氧化钙(CaO2):微溶于水,与水反应生成Ca(OH)2(微溶)和O2。
根据以上介绍,你认为运输鲜活水产品时应选择 加入水中。原因是: 。
16、(7分)用 的硫酸配制
的硫酸配制 硫酸,若实验仪器有:
硫酸,若实验仪器有:
A、100mL量筒 B、托盘天平 C、玻璃棒 D、50mL容量瓶 E、20mL量筒
F、胶头滴管 G、50mL烧杯 H、100mL容量瓶
(1)实验时应选用仪器的先后顺序是(填入编号)_________________________。
(2)在容量瓶的使用方法中,下列操作不正确的是(填写编号)___________________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线2cm-3cm处,用滴管滴加蒸馏水到标线
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近容量瓶刻度标线1cm-2cm处,用滴管滴加蒸馏水到刻度线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次
(3)怎样检查容量瓶是否漏水
。
15、设NA为阿伏加德罗常数值,下列说法正确的是 ( )
A、常温常压下,0.1NA个H2O分子的质量为1.8g
B、7.1g C12变为氯离子时,得到的电子数为0.1NA个
C、20℃、1.01×l05Pa时,11.2 LH2所含原子数为NA个
D、1 L0.2mol·L-1硫酸铁溶液中含有的SO42-离子数目为0.2NA个
第Ⅱ卷(非选择题 共55分)
14、鉴别碳酸钠和碳酸氢钠两种溶液,应采用的方法是( )
A、滴加NaOH溶液 B、滴加氯化钙溶液 C、加热 D、滴加石灰水
13、质量分数为a%,物质的量浓度为c mol/L 的KOH溶液,蒸发溶剂,恢复到原来温度,
若质量分数变为2a%,则物质的量浓度变为( )
A、小于2c mol/L B、等于2c mol/L
C、大于2c mol/L D、在c mol/L∽2c mol/L之间
12.以下是四种毒品的结构简式,下列有关说法不正确的是( )
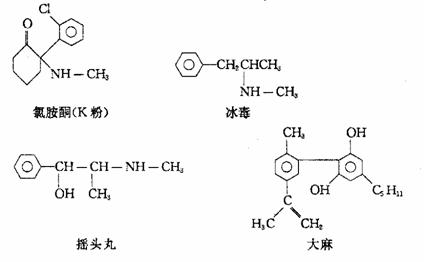
A、这四种毒品都各于芳香族化合物
B、K粉的分子式为C13H12C1NO
C、1mol大麻最多可与含3molBr2的溴水发生反应
D、摇头丸在一定条件下可发生加成反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com