
题目列表(包括答案和解析)
14.25℃时,等物质的量浓度的醋酸钠与醋酸的混合溶液pH < 7,则下列关系式中错误的是:
A.c(Na+)+ c(H+)= c(OH-) + c(CH3COO-)
B.c(CH3COO-) + c(CH3COOH) > c(Na+)
C.c(CH3COO-) > c(Na+) > c(H+) > c(OH-)
D.c(CH3COOH) > c(CH3COO-)
13.实验指出,无水氯化铝在标准大气压条件下不同温度时的密度为:
|
t(℃) |
200 |
600 |
800 |
|
d(g/mL) |
6.8×10-3 |
2.65×10-3 |
1.51×10-3 |
|
气体摩尔体积(L/mol) |
38.8 |
71.6 |
88.0 |
可见,600℃时无水氯化铝存在形式的化学式为
A.AlCl3 B.Al2Cl6 C.AlCl3和Al2Cl6 D.Al3Cl9
12.下列离子方程式书写正确的是:
A.在澄清的石灰水中通入过量的CO2:CO2+OH- HCO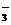
B.NaHS溶液呈碱性:HS-+H2O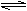
 H3O++S2-
H3O++S2-
C.4 mol/L的KAl(SO4)2溶液与7 mol/L的Ba(OH)2溶液等体积混合:
4Al3++7SO42-+7Ba2++14OH-==2Al(OH)3↓+2AlO2-+7BaSO4↓+4H2O
D.将过量的SO2气体通入Ca(ClO)2溶液中:SO2+ClO-+H2O==HClO+HSO3-
11.阿伏加德罗常数约为6.02×1023mol-1,下列说法中错误的是:
A.16.9 g BaO2固体中阴、阳离子总数约为0.3×6.02×1023
B.2.3 g 钠被O2完全氧化时,失去电子数约为0.1×6.02×1023
C.0.5 mol超重水(T2O)的质子总数约为5×6.02×1023
D.常温下,11.2 L甲烷与乙烯的混合物所含氢原子的数目约为2×6.02×1023
10.短周期元素A、B、C的原子序数依次递增,它们的原子最外层电子数之和为10,A与C同主族,B原子的最外层电子数等于A原子的次外层电子数,则下列叙述正确的是:
A.原子半径:A<B<C
B.A的氢化物稳定性大于C的氢化物稳定性
C.三种元素的最高价氧化物对应水化物均可由化合反应得到
D.高温下,A单质能置换出C单质
9.有些反应看起来不能进行,而实际生产中恰被用来制备带下划线的物质,下列四个反应中,其反应原理与其它三个反应不同的是:
A.KC1O4+H2SO4→HC1O4+KHSO4 B.KC1+NaNO3→NaC1+KNO3
C.Mg+2RbC1→MgC12+2Rb D.Na+KC1→NaC1+K
8.聚合氯化铝(PAC)通式为[Al2(OH)nCl6-n]m,是无机高分子絮凝剂,它是用软铝矿(主要成分Al2O3·H2O)为原料制备,制备的最后一步反应是将Al(OH)3凝胶与[Al(OH)2(H2O)4]Cl按照一定配比恰好完全反应制得PAC,则该反应中前者与后者的物质的量之比为:
A.1:1  B.
B.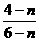 C.
C.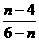 D.
D.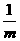
7.有关键能数据如表:
|
化学键 |
Si-O |
O=O |
Si-Si |
|
键能/kJ·mol-1 |
X |
498.8 |
176 |
则晶体硅在氧气中燃烧的热化学方程式:Si(s)+O2(g)==SiO2(s)中,△H= -989.2 kJ·mol-1,则X的值为:
A. 460 B. 920 C. 1165.2 D. 423.3
6.水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O,下列说法正确的是:
A.硫元素被氧化,铁元素被还原 B.Fe2+、S2O32-都是还原剂
C.x=2 D.每生成1mol Fe3O4,则转移电子数为3mol
5.某无色溶液中,若加入NaClO溶液或适量HCl溶液,均能产生淡黄色沉淀。则该溶液中可能大量存在的离子组是:
A.Na+、K+、S2-、Cl- B.H+、Na+、S2-、NO3-
C.K+、Ca2+、S2-、SO32- D.Na+、S2-、SO32-、SO42-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com