
题目列表(包括答案和解析)
4.Mg(OH)2的溶解度小于MgCO3。所以在碱性溶液中Mg2+总是转化为Mg(OH)2沉淀,产生的MgCO3也会在加热的条件下逐渐转化为Mg(OH)2[MgCO3+H2O(沸水)=Mg(OH)2+CO2↑]。
[典型例题评析]
例1 在下列各物质中,加入过量盐酸后,最终不产生沉淀或浑浊的是(1997年上海高考题)
A.偏铝酸钠溶液 B.苯酚钠溶液 C.硅酸钠溶液 D.硫代硫酸钠溶液
思路分析:各选项中产物依次为Al(OH)3、C6H5OH、H2SiO3、S。但Al(OH)3是两性氢氧化物,能溶于过量的盐酸中。
答案:A
方法要领:注意盐酸的量,氢氧化铝溶于强酸;苯酚微溶于水,通常呈浑浊,而不是沉淀,常用分液法分离。复习中注意归纳物质的化学性质,搞清反应物用量不同时的有关实验现象。
例2 将等物质的量的镁和铝相混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是(1996年上海高考题)
A.3mol/LHCl B.4mol/LHNO3 C.8mol/LNaOH D.18mol/LH2SO4
思路分析:在镁、铝混合物中加入HNO3和浓H2SO4(两物质均具有强氧化性)都不能产生H2,加入NaOH溶液只有Al与NaOH溶液反应生成H2而与Mg不反应。而加入HCl,Mg和Al都与盐酸反应生成H2,所以H2量最多。
答案:A
方法要领:该题溶液的浓度不是计算的数据,而是判断溶液属于“浓”或是“稀”。8mol/L以上的HCl、H2SO4、HNO3通常认为是浓酸。
解答时要注意:①等物质的量的铝和足量酸(非氧化性的酸)和碱反应放出的气体相同;②镁、铝与硝酸反应不能生成氢气;③镁与浓硫酸(18mol/LH2SO4)反应生成SO2气体,铝与浓硫酸发生钝化(常温);④镁与盐酸反应产生氢气,与NaOH溶液不发生反应。
记住Al与H+反应产生H2之间的物质的量的关系:
n(Al)-3n(H+)-n(OH-)-3/2n(H2)
例3 下列物质能跟镁反应并生成氢气的是(1995年全国高考题)
A.甲酸溶液 B.氢氧化钠溶液 C.氯化铵溶液 D.碳酸钠溶液
思路分析:镁为金属与H+反应而产生氢气:Mg+2H+=Mg2++H2↑。
答案:A、C
方法要领:酸中的有机酸也可与较活泼金属反应。解题中防漏选C,氯化铵水解其溶液呈酸性,产生的H+可与Mg反应产生氢气。
例4 甲、乙两烧杯中各盛有100mL3mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,则加入铝粉的质量为
A.5.4g B.3.6g C.2.7g D.1.6g
思路分析:根据铝与盐酸和氢氧化钠溶液反应的方程式判断,若在含等物质的量的HCl和NaOH溶液中分别加入足量的铝粉,产生的H2之比为1:3。而题中为1:2,说明铝粉的量相对盐酸是过量的,而对NaOH是不足的。与前者反应的铝粉是2.7g,则与后者反应的铝粉应为5.4g。
答案:A
一题多解:解题关键是判断Al在哪种溶液中是完全反应的,并以它作为计算的依据。
根据化学反应:2Al+6HCl=2AlCl3+3H2↑ 2Al+2H2O+2NaOH=2NaAlO2+3H2↑
可见相同质量的铝分别与足量盐酸、氢氧化钠溶液反应时产生氢气的量相同;但相同质量的铝分别与不足量的盐酸、氢氧化钠溶液反应时产生氢气的量不相同,需要盐酸的物质的量比氢氧化钠多。现产生H2的质量比为1:2,说明盐酸的量不足,于是根据0.3mol盐酸产生H2为0.15mol,可知与NaOH反应产生的H2为0.3mol,再推得放入相同质量的铝片应为0.2mol,即5.4g。
例5 若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,可能共存的是(1995年上海高考题)
A.NH4+ NO3- CO32- Na+ B.Na+ Ba2+ Mg2+ HCO3-
C.NO3- Ca2+ K+ Cl- D.NO3- K+ AlO2- OH-
思路分析:铝粉加入酸溶液或强碱溶液中均可放出H2,A中NH4+与OH-不能大量共存,CO32-不能与H+大量共存;B中HCO3-既能与H+反应又能与OH-反应;C、D在强碱条件下可以共存。
答案:C、D
方法要领:解该题要把题干中“加入铝粉能放出氢气的溶液中”的题设要求迁移为在酸性溶液或强碱溶液中,这样就变成了一般的离子共存问题了。
例6 将溶液(或气体)X,逐渐加入(或通入)到一定量的Y溶液中,产生沉淀的量与加入

 X物质的量的关系如图,符合图中情况的一组物质是(1991年上海高考题)
X物质的量的关系如图,符合图中情况的一组物质是(1991年上海高考题)
|
|
A |
B |
C |
D |
|
X |
H2S |
HCl |
NH3 |
NH3.H2O |
|
Y |
Na2SO3 |
NaAlO2 |
AlCl3 |
AgNO3 |
思路分析:由图可知,B中加入试剂1份,沉淀完全,再加入3份,
沉淀全溶解。
NaAlO2+HCl+H2O=Al(OH)3↓+NaCl Al(OH)3+3HCl=AlCl3+3H2O
A中二者反应生成S,继续通入不溶解;C中通入NH3生成沉淀,继续通入也不溶;而D中AgNO3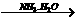 AgOH↓
AgOH↓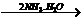 [Ag(NH3)2]++OH-。
[Ag(NH3)2]++OH-。
答案:B
方法要领:有关图像的问题,通常的解法是“三看”:
一看起点:即加入极少量X物质时,看能否产生沉淀。
二看终点:即加入过量的X物质时,看所生成的沉淀能否全部消失。A组中生成的沉淀S,不溶于过量的H2S,C组中生成的Al(OH)3沉淀不溶于过量的NH3.H2O中。
三看“拐点”:即图像中拐弯的点在X轴上的坐标。也就是生成最大量沉淀所需X的量与完全溶解这些沉淀所需X量的比值。在B组中拐点前后比为1:3,在D组中,拐点前后比为1:2。
前二“看”直观,难度较小,所以应先考虑。第三“看“难度大些,要求正确书写出变化过程中的反应方程式,尤其是方程式中的化学计量数。
例7 怎样将氯化铝和氯化铁的混合溶液分离成氯化铝和氯化铁两种溶液?(写出实验操作步骤和有关离子方程式)(1994年上海高考题)
思路分析:本题属于物质的分离题,题中文字虽少,但它考查的知识面却比较广,要答好这道题,必须对Al3+、Fe3+性质的差异及各自相互转化条件和关系有清楚的认识。答好这类题要注意当步骤较多时,应考虑周全、条理清晰、分步列答。
答案:(1)向混合液中加过量NaOH溶液,过滤。Al3++4OH-=AlO2-+2H2O,Fe3++3OH-=Fe(OH)3↓
(2)把Fe(OH)3沉淀洗涤后加入盐酸到沉淀完全溶解得FeCl3溶液。Fe(OH)3+3H+=Fe3++3H2O
(3)取步骤(1)所得滤液,加入适量盐酸(或通入足量CO2)至完全沉淀为止。AlO2-+H++H2O=Al(OH)3↓(或AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-)
(4)再过滤,沉淀经洗涤后,再用盐酸溶解,得AlCl3溶液:Al(OH)3+3H+=Al3++3H2O
方法要领:一、为使Al3+、Fe3+完全分离,步骤(1)所加NaOH溶液必须过量,这是答题时考虑的;二、在(2)、(4)两步中,洗涤沉淀的目的是洗去沉淀里吸附的可溶性杂质离子,这属较高层次要求,答题时洗涤操作不写会扣分;三、在(3)步中,若加入过量盐酸,直接得到AlCl3溶液,因混有Na+使制得AlCl3溶液不纯,因此在步骤中要注意不要犯这种错误。
 例8 四种化合物①NaHCO3,②Al(OH)3,③(NH4)2S,④CH2-COOH中,跟盐酸和氢氧化钠溶液
例8 四种化合物①NaHCO3,②Al(OH)3,③(NH4)2S,④CH2-COOH中,跟盐酸和氢氧化钠溶液
NH2
都能反应的是(1991年全国高考题)
A.只有②④ B.只有①② C.只有①②③ D.①②③④
思路分析:该题在于考查对氨基酸中羧基和氨基的酸碱性的认识,并联系无机化学中的有关物质,归纳“既能与酸反应,又能和碱反应”的物质类别。
题中Al(OH)3和NH2CH2-COOH均是两性化合物,它们既能跟酸反应,又能跟碱反应。氨基酸反应方程式为:



 CH2-COOH+HCl→CH2-COOH CH2-COOH+NaOH→CH2-COONa+H2O
CH2-COOH+HCl→CH2-COOH CH2-COOH+NaOH→CH2-COONa+H2O
NH2 NH3+Cl- NH2 NH2
NaHCO3是弱酸酸式盐,HCO3-能跟H+结合生成H2O和CO2,又能跟OH-结合生成H2O和CO32-,(NH4)2S是弱酸弱碱盐,其中S2-遇H+生成H2S,NH4+遇OH-生成NH3和H2O。综上所述,题中的四种化合物都能与盐酸和NaOH溶液反应。
答案:D
引申发散:既能与强酸反应又能与强碱反应的物质有:①Al、Be,②Al2O3、BeO,③Al(OH)3、Be(OH)2,④弱酸的酸式盐,如:HCO3-、HSO3-、HS-、HPO42-、H2PO4-,⑤弱酸的铵盐,如(NH4)2S、(NH4)2CO3⑥有机物:氨基酸、蛋白质。
例9 在一定条件下可实现下图所示物质之间的转化:(1995年全国高考题)
 请填写以下空白:
请填写以下空白:
(1)孔雀石的主要成分是CuCO3.Cu(OH)2(碱式碳酸铜),受热易分解。下图中的F是_____。
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式:______________________。
(3)图中所得G和D都为固体,混和后在高温下可发生反应,写出该反应的化学方程式:______________________。
(4)每生成1molD,同时生成____molE。
思路分析:A为NaAlO2,反应式Al3++4OH-=AlO2-+2H2O。孔石分解的反应式:CuCO3.Cu(OH)2=2CuO+CO2↑+H2O F是CO2,A、F发生的反应式是CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,沉淀C是Al(OH)3,受热分解后生成Al2O3(B)和水。
Al和CuO的反应,类似于铝热反应。
|
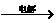 4Al+3O2↑求解。
4Al+3O2↑求解。
答案:(1)CO2(或二氧化碳) (2)Al3++4OH-=AlO2-+2H2O (3)3CuO+2Al=====Al2O3+3Cu
(4)3/4
方法要领:本题难度不大,着重考查基础知识。此框图题已给出的起始物质,可顺向推导。
例10 我国规定饮用水质量标准必须符合下列要求:(2000年上海高考题)
|
pH |
6.5-6.8 |
|
Ca2+、Mg2+总浓度 |
<0.0045mol/L |
|
细菌总数 |
<100个/L |
 以下是源水处理成自来水的工艺流程示意图:
以下是源水处理成自来水的工艺流程示意图:
源水→曝气池 一级沉降池 二级沉降池 过滤池→自来水
(1)源水中含Ca2+ 、Mg2+、HCO3-、Cl-等,加入石灰后生成Ca(OH)2 ,进而发生若干复分解反应,写出其中一个离子方程式 。
(2)凝聚剂除去悬浮固体颗粒的过程 (填写编号,多选倒扣分)
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4.7H2O是常用的凝聚剂,它在水中最终生成 沉淀。
(3)通入二氧化碳的目的是 和 。
(4)气体A的作用是 。这种作用是基于气体A和水反应的产物具有 性.
(5)下列物质中, 可以作为气体A的代用品。(填写编号,多选倒扣分)
①Ca(ClO)2 ②NH3 (液) ③K2FeO4 ④SO2
思路分析:自来水的质量标准从酸度、硬度、细菌总数等方面来衡量。
降低水的硬度是用石灰,降低Mg2+浓度,减少HCO3-和CO32-的含量;再通入CO2气体降低Ca2+的浓度,从而降低水的硬度,同时调pH。
降低细菌总数:靠强氧化剂的氧化性杀死细菌;常用Cl2,但近年改用Ca(ClO)2、K2FeO4、ClO2等。
除去固体悬浮物:金属离子水解形成胶体,胶粒表面积大吸附性强,而吸附悬浮物沉降,达到净水的目的。
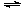
 常用的净水剂:明矾:Al3++3H2O Al(OH)3(胶体)+3H+;因Al3+在人体内聚集过多会造成老年性痴呆,故改用FeSO4.7H2O;Fe2++H2O Fe(OH)2+2H+,且4Fe(OH)2+O2+2H2O=4Fe(OH)3;Fe(OH)3胶体吸附悬浮物沉降,净水效果好。
常用的净水剂:明矾:Al3++3H2O Al(OH)3(胶体)+3H+;因Al3+在人体内聚集过多会造成老年性痴呆,故改用FeSO4.7H2O;Fe2++H2O Fe(OH)2+2H+,且4Fe(OH)2+O2+2H2O=4Fe(OH)3;Fe(OH)3胶体吸附悬浮物沉降,净水效果好。
(1)由题给信息,水中含有暂时硬度和永久硬度,加石灰后分发生如下离子反应:
Mg2++2OH-=Mg(OH)2↓;HCO3-+OH-=CO32-+H2O;Ca2++HCO3-+OH-=CaCO3↓+H2O;
 (2)凝聚剂既有水解反应,又有胶体的凝聚作用,属于物理化学过程。例如FeSO4在水中发生水解:Fe2++2H2O Fe(OH)2+2H+,Fe(OH)2极易被氧化成Fe(OH)3,Fe(OH)3能将悬浮颗粒凝聚而除去。
(2)凝聚剂既有水解反应,又有胶体的凝聚作用,属于物理化学过程。例如FeSO4在水中发生水解:Fe2++2H2O Fe(OH)2+2H+,Fe(OH)2极易被氧化成Fe(OH)3,Fe(OH)3能将悬浮颗粒凝聚而除去。
(3)通入CO2能将Ca2+除去,同时调整溶液中的pH达到饮用水质量标准:
 Ca2++2OH-+CO2=CaCO3↓+H2O
Ca2++2OH-+CO2=CaCO3↓+H2O
碱性 接近中性
(4)气体A显然是用于消毒、杀菌的Cl2,Cl2和H2O反应生成具有强氧化性的HClO。
(5)作为漂白粉有效成分的Ca(ClO)2,在CO2和H2O作用下,也会产生HClO,可以作为A的代用品。而氧化性比KMnO4还要强的铁酸盐在水中会发生还原反应,起消毒杀菌的作用,同时FeO42-中+6价的Fe被还原成+3价的Fe,也会水解,作为净水剂。
答案:(1)Mg2++OH-=Mg(OH)2↓ (2)③ Fe(OH)3 (3)将Ca2+除去,同时调整溶液中的pH达到饮用水质量标准 (4)消毒杀菌 强氧化性 (5)①和③
方法要领:此题通过饮用水的处理:水的软化、净水和消毒杀菌,考查考生能否应用有关的化学原理解决实际生产中的问题。关于K2FeO4的作用,可根据Fe处+6价,势必有很强的氧化性进行推论,展开思维。
本题以水处理为素材,切中当今社会热点问题,旨在考查学生运用知识解决实际问题的能力,同时让学生在考试过程中学习了自来水的处理,使学生眼中的化学更亲近了,看得到,摸得着,学习更有意义了。用FeSO4.7H2O和Cl2进行凝聚沉降和杀菌消毒为课本相关的基础知识。主要难点是第(5)小题易出现漏选或错选。K2FeO4(铁酸钾)是一种新型净水剂,由强氧化性的要求当可推及。
例11 氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空:
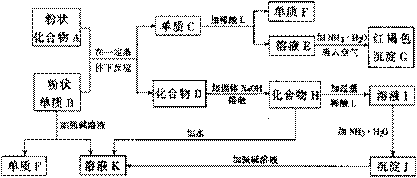
(1)单质F是_____________________。
(2)写出由E生成G的离子反应方程式(或化学方程式)________________________。 (3)溶液I中所含金属离子是_______。 (4)由C→E+F若改用浓酸,则不能选用的浓酸是(写分子式)_______________。
思路分析:粗读本题,抓住红褐色沉淀G就是Fe(OH)3逆推,则E中含Fe2+,单质C为Fe,F是H2。
由“化合物A+单质B 单质C+化合物D”,且单质C为Fe,从记忆中搜寻典型反应:3Fe3O4+8Al
单质C+化合物D”,且单质C为Fe,从记忆中搜寻典型反应:3Fe3O4+8Al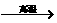 9Fe+4Al2O3 Fe2O3+2Al
9Fe+4Al2O3 Fe2O3+2Al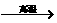 2Fe+Al2O3,则知单质B为Al,化合物D为Al2O3。
2Fe+Al2O3,则知单质B为Al,化合物D为Al2O3。
由B 为Al,推知单质F为H2,溶液K为含AlO2-的溶液,其反应是:
2Al+2OH-+2H2O=2AlO2-+3H2↑
由K溶液中含AlO2-,逆推化合物H为NaAlO2。化合物H也可由D结合题干信息推出:Al2O3+2NaOH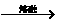 2NaAlO2+H2O。
2NaAlO2+H2O。
由H为NaAlO2推知溶液I中含Al3+,发生的反应是:AlO2-+4H+=Al3++2H2O。
继续往下推知沉淀J是Al(OH)3,因为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+,Al(OH)3溶于强碱溶液生成AlO2-(K溶液),与前面推理相吻合:Al(OH)3+OH-=AlO2-+2H2O。
答案:(1)H2 (2)4Fe2++8NH3.H2O+O2+2H2O=4Fe(OH)3↓+8NH4+或分两步写出亦可:①Fe2++2NH3.H2O=Fe(OH)2↓+2NH4+ ②4Fe(OH)2+O2+2H2O=4Fe(OH)3↓ (3)Al3+和Na+ (4)H2SO4(或HNO3)
方法要领:题中框图看起来很复杂,似乎无从下手,实际上图中有很多有关物质性质的特征信息,如红褐色沉淀G(是氢氧化铁的特征),溶于强碱的沉淀J(是氢氧化铝的特征)等。抓住这些特征可顺利推出答案。
3.注意正确理解图象的涵义。
图示中每个曲线或每条曲线的转折点(拐点),都反映了特定的反应,若没有找对,或对生成沉淀和沉淀溶解所需加入(或通入)溶液(或气体)的量之比没搞清,易导致错误。
注意研究以下几个实验现象及产生沉淀的量与加入物质的量的数量关系的图象:
①向AlCl3溶液中逐滴加入NaOH溶液直至过量;②向AlCl3和MgCl2混合中逐滴加入NaOH溶液直至过量;④向HCl、MgCl2、AlCl3混合液中逐滴加入NaOH溶液直至过量;③向NaAlO2溶液中逐滴加入HCl溶液直至过量;⑤向HCl溶液中逐滴加入NaAlO2溶液直至过量。
这些是以化学知识为载体考查学生的综合能力的重要的命题内容,认真研究一定会有益处。
2.注意对Al2O3、Al(OH)3两性的理解,以及对Al3+、AlO2-存在条件的认识。
Al2O3、Al(OH)3仅能溶于强酸和强碱溶液中(如在氨水和碳酸中均不溶),Al3+、AlO2-只能分别存在于酸性与碱性溶液中。
Al3+与下列离子不能大量共存:OH-、CO32-、HCO3-、SO32-、S2-、AlO2-,其中OH-是因为直接反应,其余均是“双水解”。
AlO2-与下列离子不能大量共存:H+、HCO3-、NH4+、Al3+、Mg2+、Cu2+。其中H+和HCO3-是因为直接反应(AlO2-+ HCO3-+H2O=Al(OH)3↓+CO32-),其余也是“双水解”。
1.镁是活泼金属,虽不跟碱性溶液反应,但能置换出酸中的氢,也能与水解呈酸性的盐溶液反应产生H2。
29.(15分) (1)①;(3分) (2)羧基、溴原子;(3分,写结构简式也给分)
(3)A:CH2=CHCH2OH;(3分) E:CH2BrCHBrCOOCH2CH3;(3分)
(4)CH3COOCH2CHBrCH2Br+3NaOH → CH3COONa+CH2OHCHOHCH2OH+2NaBr (3分)
27.(15分) H
‥ ‥ ︳
(1)Na+[﹕O﹕O﹕]2-Na+;(3分) H-N-H;(3分)
|
(2)2NH4Cl+Ca(OH)2 = CaCl2+2NH3↑+2H2O;(3分)
(3)Cl2+2OH-=Cl-+ClO-+H2O;(3分)
(4)H2(g)+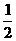 O2(g)=H2O(l);⊿H=-285.8kJ/mol (3分)
O2(g)=H2O(l);⊿H=-285.8kJ/mol (3分)
|
(1)MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O (2分) (2)增大反应接触面 (3分)
(3)水浴;(2分) 将锥形瓶放人冰水中冷却(2分)
(4)防止空气中水蒸气进入E中并吸收残留的氯气。(3分)
(5)
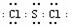 (3分)
(3分)
26.(15分) 点燃
(1)F;(3分) SO2、SO3;(3分) (2)2Mg+CO2=2MgO+C;(3分)
(3)H2O>HF>CH4;(3分)
(4)Al(OH)3+OH-=AlO2-+2H2O;(3分,写Al2O3或Al与NaOH溶液的离子方程式也给分)
|
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
|
D |
C |
C |
B |
B |
B |
C |
C |
29.(15分)
现有A-F六种化合物,有关它们的信息如下。①、②中有一反应是与Br2的CCl4溶液的加成反应。1molF在碱性条件下水解生成1molG和1molH。G为油脂的水解产物。
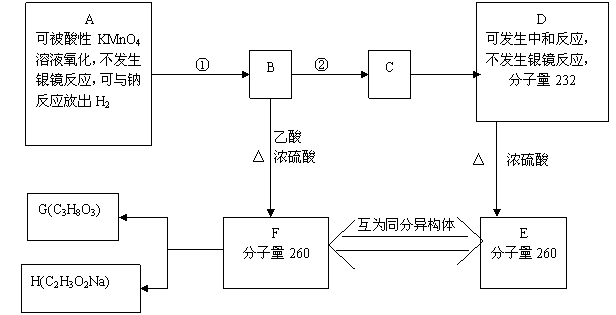
 请回答下列问题
请回答下列问题
(1)与Br2的CCl4溶液发生加成反应的是__________ (填反应编号①或②)
(2)D中含有的官能团有________________
(3)A的结构简式为________________;E的结构简式为________________
(4)写出F在碱性条件下水解的化学方程式
_________________________________________________________________________________
答 案 及 评 分 标 准
28.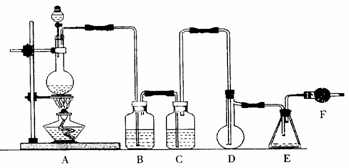 (15分)二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/mL,遇水易分解。以下是氯气与硫合成二氯化硫的实验装置。
(15分)二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/mL,遇水易分解。以下是氯气与硫合成二氯化硫的实验装置。
试回答下列问题
(1)装置A中发生反应的化学方程式为 。
(2)实验开始前先在D中放一定量的硫粉.加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是 。
(3)实验时,D装置需加热至50-59℃.最好采用 方式加热。如何防止E中液体挥发 。
(4)F装置中干燥管内所盛物质的作用是 。
(5)二氯化硫电子式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com