
题目列表(包括答案和解析)
25.(10分)A、B、C、D为四种不同的有机物,完全燃烧均生成等物质的量的CO2和
H2O,且都能通过一步反应生成乙醇,它们的相对分子质量依次递增。A、B、D均能使酸性高锰酸钾溶液褪色。B、D均能发生银镜反应。
(1)写出B和D的结构简式:
B ;D 。
(2)上述四种物质中,来自石油化工的是__________(写物质名称),写出该物质转变成乙醇的反应方程式 ,该反应类型为 反应。
(3)写出C与氢氧化钠溶液共热的化学方程式 。
(4)配平下列化学方程式
CH3CH2OH + KMnO4 + → CH3COOH + MnSO4 + K2SO4 + H2O
24.(11分)已知A、B、C、D四种短周期元素的原子序数依次增大,B的核电荷数是A、D核电荷数之和的 倍;A能分别与B、C、D形成电子总数相等的分子X、Y、Z 。回答下列问题:
倍;A能分别与B、C、D形成电子总数相等的分子X、Y、Z 。回答下列问题:
(1)B元素的名称是 ,D的原子结构示意图为 。
(2)化合物B2A2的电子式为 。
(3)Y与C的最高正价氧化物的水化物刚好完全反应时,其生成物的水溶液呈 性(填“酸”“碱”或“中”),其原因是(用离子方程式表示) 。
(4)在(3)所得生成物的水溶液中,存在着如下关系,用粒子浓度符号填写(每空只能填一种粒子的浓度):
① c(H+) + = c(OH-) + ;
② c(H+) = c(OH-) + 。
23.(10分)现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用。某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(Si02) ,现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进入有机层的过程)和反萃取(铜从有机层进入水层的过程)是现代湿法炼铜的重要工艺手段。
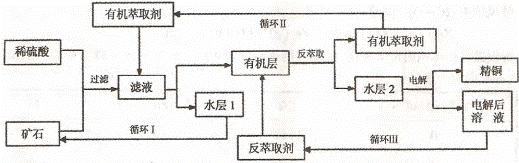
已知:①Cu2O+2H+=Cu2++Cu + H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜; ③反萃取后的水层2是硫酸铜溶液。回答下列问题:
(1)矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu + H2O
、 (写其中2个)
(2)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体,该晶体的化学式是 。若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层l暴露在空气中发生反应的离子方程式
(3)“循环n”中萃取剂是一类称作为肟类的有机化合物,如N一510、N一530等。某肟类化合物A的分子结构中仅含n1个-CH3、n2个一OH和n3个 三种基团,无环状结构,三种基团的数目关系为n3 =
。若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是
三种基团,无环状结构,三种基团的数目关系为n3 =
。若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是
(4)“循环Ⅲ”中反萃取剂的主要成分是
22.(12分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
 ⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
△H=-49.0kJ/mol
CH3OH(g)+H2O(g)
△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)。氢气的转化率= 。
②该反应的平衡常数表达式为__________________。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
⑵在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2 CO2=2 CO+O2,CO可用作燃料。
已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O
则阴极反应式为:________________________________。
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断是否可行并说出理由:______________________________________________。
21.(9分)化合物KxFe(C2O4)y·3H2O(Fe为+3价)是一种光敏材料,实验室可以用如下的方法来制备这种材料并测定这种材料的组成。
Ⅰ.制备
 K2C2O4
K2C2O4
FeCl3
⑴结晶时应将溶液用冰水冷却并在黑暗处等待晶体的析出,这样操作的原因是:________________________________________________________________。
⑵操作Ⅲ的名称是___________。
Ⅱ.组成测定
称取一定质量的晶体置于锥形瓶中,加入足量的蒸馏水和稀H2SO4,将C2O42-转化为H2C2O4后用0.1000 mol·L-1KMnO4溶液滴定,当消耗KMnO4溶液24.00mL时恰好完全反应;再向溶液中加入适量的还原剂,恰好将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液4.00mL。相关反应的化学方程式如下:
2 KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
⑶配制100mL 0.1000 mol·L-1KMnO4溶液及滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有_______________________________(填仪器名称)。两个滴定中,终点时溶液颜色为________色,且30 秒内不变色。
⑷该化合物KxFe(C2O4)y·3H2O中,x=_______。
20.(15分)硫酸铜是一种应用极其广泛的化工原料。制备硫酸铜是无机化学实验教学中一个重要的实验。由于铜不能与稀硫酸直接反应,实验中将浓硝酸分次加入到铜粉与稀硫酸中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)。
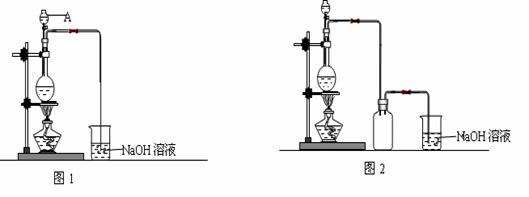
(1)图1中,A仪器的名称为 ,烧瓶中发生的离子反应方程式 。
(2)图2是图1的改进装置,改进的目的是 。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加FeSO4或Fe2(SO4)3,反应完全后,向其中加物质甲调节pH到3-4,过滤、蒸发、结晶,滤渣作催化剂循环使用。(已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4。)
请回答下列问题:
①方案1中的B仪器名称是 。
②方案2中甲物质是 (填字母序号)。a、CaO b、CuCO3 c、CaCO3
调节pH到3-4的目的是: 。
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol/L的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h后,升温到60℃,持续反应1 h后,过滤、蒸发结晶、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.6g。请回答下列问题:
③该反应的离子反应方程式为 。
④控制温度在50℃和60℃加热的原因为 ,晶体采用酒精淋洗的优点是 。
⑤上述两种氧化法中,更符合绿色化学理念的是 (填“第一组”或“第二组”),理由是 。
19.(10分)文献资料显示,草木灰主要含有不溶性杂质及K2CO3,还含有少量KCl、K2SO4等。某化学兴趣小组拟测定草木灰中钾盐的含量及钾盐中K2CO3的含量。
[测定草木灰中钾盐含量]
(1)该实验的主要步骤顺序为:称量.→ → → → →冷却→再称量(填字母序号)
A. 溶解 B.过滤 C、洗涤、烘干 D、蒸发
(2)称量前,在调整托盘天平的零点时,若指针偏向右边,应将右边的螺丝向 (填左、右)旋动。某学生称量时,在天平右盘加上规定质量的砝码后,在左盘的小烧杯中加入样品,此时指针稍偏右边,该学生的操作应为 。
(3)实验中A、B、C、D三步操作均使用了玻璃棒,操作B中玻璃棒的作用是 ,操作D用玻璃棒不断搅动的原因 。
[测定钾盐中K2CO3含量]
(4)取上述操作中所得的钾盐,配成稀溶液,加入CaCl2溶液使CO32-生成沉淀,过滤得到碳酸钙沉淀后,用蒸馏水多次洗涤,烘干、称量、计算。检验沉淀是否完全的方法是 ,检验沉淀是否洗净的方法是 。
18.某温度下,在密闭容器中存在下列可逆反应:A(g)+2B(g)
 4 C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1,且A的质量分数为w%。保持温度不变,再充入A、B、C的物质的量分别为a、b、c,则下列说法正确的是
4 C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1,且A的质量分数为w%。保持温度不变,再充入A、B、C的物质的量分别为a、b、c,则下列说法正确的是
A.若为恒容容器,当a∶b∶c为2∶2∶1时,平衡不移动
B.若为恒容容器,当a∶b =9∶10,且c=0时,达平衡后,A、B、C物质的量之比仍为2∶2∶1
C.若为恒压容器,当a∶b为9∶10,c为任意值时,平衡后A的质量分数一定仍为w%
D.若为恒压容器,当a=b=0,且c为任意值时,平衡后A的质量分数小于w%
17.有机电解制备的金属醇盐,可直接作为制备纳米材料的前体。以下是一种电化学合成金属醇盐的主要装置。在电解过程中,已知乙醇和乙酰丙酮(CH3COCH2COCH3)在阴极发生的电极反应为:
2CH3CH2OH+2e-=2CH3CH2O-+H2↑



下列说法正确的是
A.阳极Pb失去电子,发生还原反应
B.当阳极失去2 mol e-时,阴极产生2 mol氢气
C.电解过程中,阳离子向阴极移动
D.已知Pb-4e-=Pb4+,当消耗Pb的质量为103.5 g时,则转移电子2 mol
16.将某NaOH溶液分成两等份,一份用pH=2的一元酸HA溶液中和,消耗酸溶液的体积为V1;另一份用pH=2的一元酸HB溶液中和,消耗酸溶液体积为V2,则下列叙述正确的是:
A.若V1>V2,则说明HA的酸性比HB的酸性强
B.若V1>V2,则说明HA的酸性比HB的酸性弱
C.若中和所得混合液的pH前者大于后者,则V1>V2
D.若中和所得混合液的pH前者小于后者,则V1>V2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com