
题目列表(包括答案和解析)
17.(11分)碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平)
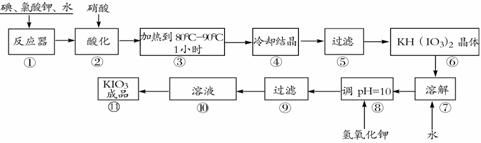
(1)碘的原子序数为________。
(2)在反应器中发生的反应I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平),生成两种还原产物所得电子数目相同,请写出已配平的该反应的化学方程式:________________________________________________________。若有1 mol I2完全反应,则该反应中转移电子的数目为________(设NA表示阿伏加德罗常数)
(3)步骤②中,用硝酸而不用HI,其原因可能是________________________。
(4)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为________________________________。
(5)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是________________________________。
|
温度/℃ |
0 |
10 |
20 |
40 |
60 |
80 |
|
KIO3g/100g水 |
4.60 |
6.27 |
8.08 |
12.6 |
18.3 |
24.8 |
(6)KIO3可用电解的方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为KI+H2O=KIO3+H2↑,则两极的电极反应式分别为:
阴极________________________________________,阳极________________________________________。
(7)根据你的生活经验和化学知识,谈谈怎样正确使用加碘盐?________________________________________。
(只要说出一种即可)
(1)53;(2)6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2、10NA;(3)HI具有还原性,能将已生成的碘酸氢钾还原;(4)Cl2能将KIO3氧化成KIO4;(5))蒸发结晶;(6)6H2O+6e-=2H2↑+6OH-、I-+6OH--6e-=IO3-+2H2O;(7)做好饭菜再放食盐
16.(9分)硅和氮均是自然界含量丰富的元素,其单质及其化合物在环境、能源及材料科学中有着重要影响和广泛应用。试回答下列问题:
(1)向大气中排放NOx可能导致的环境问题有____________________________、____________________________________________。(答两点)已知足量NaOH溶液能完全吸收NO2生成两种含氧酸盐,试写出该反应的离子方程式____________________________________________________________________________。
(2)光导纤维的使用,让人们的生活更加丰富精彩,___________是制备光导纤维的基本原料。
(3)氮化硅陶瓷是一种新型无机非金属材料,其化学式为___________,可由硅粉(用Al2O3和Y2O3作助剂)在氮气中高温烧结而成,氮气在反应中既是反应物,同时又起了_____________作用。由于使用的硅粉表面含二氧化硅,在反应中需加入碳粉。在烧结过程中,二氧化硅、碳、氮气以物质的量之比3:6:2反应生成两种化合物,该反应的化学方程式为_________________________________。若已知CO生成速率为v(CO)=18 mol·L-1·min-1,则N2消耗速速率为v(N2)=______________ mol·L-1·min-1。
(4)硅燃烧放出大量热量,“硅能源”有望成为二十一世纪的新能源。与“氢能源”比较“硅能源”具有________________________________等更加优越的特点,从而得到全球的关注和期待。
(1)酸雨、光化学烟雾、臭氧层破坏(2分,只要答出任意两点,答出一点给一分),2NO2+2OH-=NO3-+H2O(2分);(2)SiO2或二氧化硅(1分);(3)Si3N4(1分),防止硅和氮化硅氧化或作保护气(1分) 3SiO2+2N2+6CSi3N4+6CO(2分,不写反应条件扣1分)、6;(4)便于储运,比较安全等(1分,只要答出一点合理优点即可)
15.醋酸是重要的一元酸,在有机和无机反应中都有应用。
(1)在酯化反应的实验中,乙酸、乙醇的用量和平衡时乙酸乙酯的生成量如下表
|
反应 |
乙醇/kmol |
乙酸/kmol |
乙酸乙酯/kmol |
|
1 |
2 |
2 |
1.33 |
|
2 |
3 |
2 |
1.57 |
|
3 |
4 |
2 |
X |
|
4 |
5 |
2 |
1.76 |
①该酯化反应的平衡常数K的表达式为:K=______________________________
②由表中数据推测,数值X的范围是____________推断的依据为________________________
③假设乙醇的价格为500元/k mol,乙酸乙酯的价格为1600 元/kmol,同反应2相比,反应3的经济效益________(填:增加或减少)
(2)10 mL 0.10 mol·L-1的稀醋酸中存在着平衡:CH3COOH CH3COO-+H+。①向稀醋酸中不断加水②向稀醋酸中慢慢滴加0.10 mol·L-1的稀氢氧化钠溶液。①中醋酸电离度的变化图线已画出,请你在下图中画出②过程中醋酸电离度的变化图线
CH3COO-+H+。①向稀醋酸中不断加水②向稀醋酸中慢慢滴加0.10 mol·L-1的稀氢氧化钠溶液。①中醋酸电离度的变化图线已画出,请你在下图中画出②过程中醋酸电离度的变化图线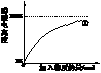
(1)K=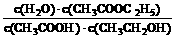 (2分);(2)1.57<X<1.76(1分),在乙酸的物质的量相同条件下,增加乙醇的物质的量平衡向右移动,乙酸乙酯的物质的量增加,减少乙醇的物质的量平衡向左移动,乙酸乙酯的物质的量减少(2分);(3)减少(1分)
(2分);(2)1.57<X<1.76(1分),在乙酸的物质的量相同条件下,增加乙醇的物质的量平衡向右移动,乙酸乙酯的物质的量增加,减少乙醇的物质的量平衡向左移动,乙酸乙酯的物质的量减少(2分);(3)减少(1分)
(4)(2分)
14.(2008滨州一质检)已知25℃时,电离常数Ka(HF)=3.6×10-4 mol·L-1,溶度积常数KSP(CaF2)=1.46×10-10 mol3·L-3。现向1 L 0.2 mol·L-1 HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中正确的是C
A.25℃时,0.1mol·L-1HF溶液中pH=1 B.KSP(CaF2)随温度和浓度的变化而变化
C.该体系中有CaF2沉淀产生 D.以上说法均不正确
12.已知A、B元素同周期,且电负性A<B,下列说法正确的是AC
A.A与B形成化合物时,A显正价,B显负价且A原子的半径大于B原子的半径
B.第一电离能不可能B小于A
C.最高价含氧酸的酸性:A对应的酸性弱于B对应的酸性
D.气态氢化物的稳定性:HmB小于HnA
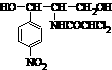 13.2007年 1月20日有关媒体报道“迪豆痘速消含氯霉素”事件。连日来,全国各省市卫生、质检、工商等部门已经对市面上销售的迪豆痘速消立即进行了多批次反复抽检。各地卫生主管部门最新通报,所有检测报告结果均表明迪豆痘速消不含氯霉素,安全合格,广大消费者可放心选购使用。氯霉素是世界上第一个用化学方法全合成的抗生素,它的化学结构式如图。下列有关说法不正确的是BC
13.2007年 1月20日有关媒体报道“迪豆痘速消含氯霉素”事件。连日来,全国各省市卫生、质检、工商等部门已经对市面上销售的迪豆痘速消立即进行了多批次反复抽检。各地卫生主管部门最新通报,所有检测报告结果均表明迪豆痘速消不含氯霉素,安全合格,广大消费者可放心选购使用。氯霉素是世界上第一个用化学方法全合成的抗生素,它的化学结构式如图。下列有关说法不正确的是BC
A.氯霉素的化学式为C11H12O5N2Cl2
B.氯霉素分子中至多有7个原子碳共面
C.氯霉素能与FeCl3溶液发生显色反应
D.氯霉素在一定的条件下能分别与溴、Na、NaOH发生取代反应
解析:在氯霉素的结构式中知道交叉处为碳原子,碳满足四个价键,不足的用氢原子补,马上知道氯霉素的化学式为C11H12O5N2Cl2。氯霉素学名是D-苏式-1-对硝基苯基-2-二氯乙酰胺基-1,3-丙二醇,中含有官能团硝基、苯环、醇羟基和卤素氯,在一定的在加热和催化剂作用下,1mol氯霉素能被4 mol氢气还原(其中有苯环上3 mol,二氯乙酰胺基上1 mol);氯霉素在一定的条件下能分别与溴(苯环上发生)、Na(醇羟基上发生)、NaOH(卤素氯)发生取代反应。氯霉素没有酚类结构不能与FeCl3溶液发生显色反应。
11.C解析:考虑水解AlCl3+3H2O Al(OH)3+3HCl,加热HCl挥发,蒸干得到的是Al(OH)3,灼烧分色为Al2O3,A项错;B项c(NH4+)最大的是(NH4)2SO4,由水的电离可知C项正确,D项要求离子存在的条件是中性溶液,而Al3+、Cl-因水解只能存在于酸性溶液中,D项错。
Al(OH)3+3HCl,加热HCl挥发,蒸干得到的是Al(OH)3,灼烧分色为Al2O3,A项错;B项c(NH4+)最大的是(NH4)2SO4,由水的电离可知C项正确,D项要求离子存在的条件是中性溶液,而Al3+、Cl-因水解只能存在于酸性溶液中,D项错。
11.下列说法正确的是
A.制备AlCl3晶体:将AlCl3溶液加热、蒸干,并灼烧
B.物质的量浓度相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中c(NH4+):c(NH4HSO4)>c[(NH4)2SO4]> c(NH4Cl)
C.1.0 mol·L-1 Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
D.在c(H+)= 的溶液中一定存在如下离子:Na+、Al3+、NO3-、Cl-
的溶液中一定存在如下离子:Na+、Al3+、NO3-、Cl-
10.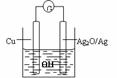 普通水泥在固化过程中自由水分子减少并产生,溶液呈碱性。根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间。此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的是AC
普通水泥在固化过程中自由水分子减少并产生,溶液呈碱性。根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间。此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的是AC
A.工业上以黏土、石灰石为主要原料来制造水泥
B.测量原理示意图中,Ag2O为负极
C.负极的电极反应式为:2Cu+2OH--2e-=Cu2O+H2O
D.电池工作时,OH-向正极移动
9.下列说法中,不正确的是 C
A.在NaAlO2溶液中,HSO3-(H2SO3的电离常数K1=1.5×10-2;K2=1.0×10-7)不能大量存在
B.在0.1 mol·L-1的CH3COOH溶液中加入适量的蒸馏水,溶液中的c(OH-)增大
C.在由水电离出的c(OH-)=1×10-12 mol·L-1的溶液中,Al3+一定不能大量存在
D.室温下pH=6的酸性溶液中,可能存在NH3·H2O分子
8.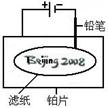 某学生设计了如图所示的“黑笔写红字”的趣味实验。滤纸上先用NaCl和无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹--“
某学生设计了如图所示的“黑笔写红字”的趣味实验。滤纸上先用NaCl和无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹--“ ”。据此,下列叙述不正确的是C
”。据此,下列叙述不正确的是C
A.铅笔作阴极,电极反应为:2H++2e-=H2↑
B.铂片作阳极:电极反应为:2Cl--2e-=Cl2↑
C.铅笔与滤纸接触处有少量Cl2逸出
D.上述反应总的离子方程式可表示为2Cl-+2H2O Cl2↑+H2↑+2OH-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com