
题目列表(包括答案和解析)
21.(10分)根据下列框图关系填空,已知反应①、③是我国工业生产中的重要反应,X常温下为无色无味透明液体;C焰色反应火焰呈黄色,J为红褐色沉淀;D、E常温下为气体,且E能使品红溶液褪色;A固体中仅含两种元素,其中金属元素的质量分数约为46.7%。
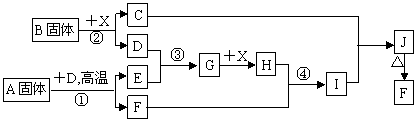
(1)G的化学式为 ;
(2)固体A中所包含的化学键与固体B类似,则A的电子式为 ;
(3)反应②的离子方程式: ;
(4)反应④的离子方程式: ;
(5)已知每生成16 g E,放出106.5 kJ热量,则反应①的热化学方程式为:
。
20.(12分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3+CO2+H2O NH4HCO3 ; NH4HCO3+NaCl NaHCO3↓+NH4Cl ;
 2NaHCO3 Na2CO3+CO2↑+H2O
2NaHCO3 Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号)。
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
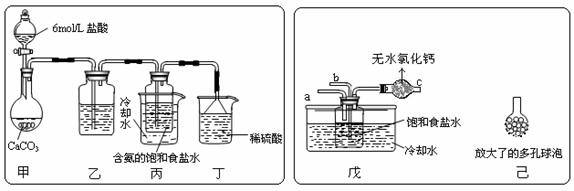
试回答下列有关问题:
 (Ⅰ)乙装置中的试剂是 ;
(Ⅰ)乙装置中的试剂是 ;
(Ⅱ)丁装置中稀硫酸的作用是 ;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从 管通入 气体,再从 管中通入 气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 ;
(3)请你再写出一种实验室制取少量碳酸氢钠的方法: 。
19.现有100 mL 溶质为MgCl2和AlCl3的混合溶液,其中c(Cl-)=1.0 mol·L-1,c(Mg2+)=0.2mol·L-1。若不考虑水解因素,则要使其中的Mg2+全部转化为Mg(OH)2沉淀而分离出来,至少需要4mol·L-1的NaOH溶液的体积是
A.25mL B.5mL C.30mL D.100mL
08届高三质量检测化学试卷
第Ⅱ卷(非选择题,共63分)
18.常温下,下列各溶液的叙述中正确的是
A.0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后溶液显酸性
c (Ac-)>c (Cl-)>c (H+)>c (HAc)
B.pH=7的醋酸钠和醋酸混合液中:c(Na+)= c(CH3COO-)
C.0.1mol/L的醋酸的pH=a,0.01mol/L的醋酸的pH=b,则a+1>b
D.已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中,
[c(Na+)-c(F-)]< [c(K+)-c(CH3COO-)]
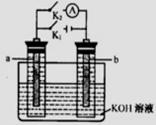
17.如右图所示,a、b是多孔石墨电极,某同学按图示装置进行如下 实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是
A.断开K2,闭合K1一段时间,溶液的pH要变大
B.断开K1,闭合K2时,b极上的电极反应式为: 2H++2e-=== H2↑
C.断开K2,闭合K1时,a极上的电极反应式为:4OH-―4e-=== O2↑十2H2O
D.断开K1,闭合K2时,OH-向b极移动
16. 磷化硼是一种超硬耐磨涂层材料。右图为其晶体结构中最小的重复 结构单元,其中的每个原子均满足8电子稳定结构。下列有关说法正确 的是
磷化硼是一种超硬耐磨涂层材料。右图为其晶体结构中最小的重复 结构单元,其中的每个原子均满足8电子稳定结构。下列有关说法正确 的是
A.磷化硼晶体的化学式为BP,属于离子晶体
B.磷化硼晶体的熔点高,且熔融状态下能导电
 C.磷化硼晶体中每个原子均形成4根共价键
C.磷化硼晶体中每个原子均形成4根共价键
D.磷化硼晶体结构微粒的空间堆积方式与氯化钠相同
15.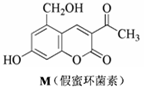 如右图所示,化合物M叫假蜜环菌甲素,它是香豆素类天然化合物。对M的性质叙述正确的是
如右图所示,化合物M叫假蜜环菌甲素,它是香豆素类天然化合物。对M的性质叙述正确的是
A.M既能与FeCl3发生反应,也能与CH3COOH发生反应
B.M与Br2只能发生取代反应,不能发生加成反应
C.M可溶于NaOH稀溶液,1molM最多消耗3mol NaOH
D.1molM在催化剂作用下最多能与4molH2发生加成反应
14.下列离子方程式书写正确的是
A.用大理石与盐酸制取CO2:CO32-+2H+ H2O+CO2↑
B.苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
C.澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2HCO3- CaCO3↓+CO32-+2H2O
D.硝酸亚铁溶液中滴加盐酸:3Fe2++4H++NO3- 3Fe3++2H2O+NO↑
13.锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一。从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:
2Sb2S3+3O2+6Fe=Sb4O6+6FeS ……………………①
Sb4O6+6C=4Sb+6CO ………………………………②
关于反应①、反应②的说法正确的是
A. 反应①②中的氧化剂分别是Sb2S3、Sb4O6
B.反应①中每生成3 mol FeS时,共转移6 mol电子
C.反应②说明高温下Sb的还原性比C强
D.每生成4 mol Sb时,反应①与反应②中还原剂的物质的量之比为4︰3
12.下列各溶液中,各离子可能大量共存的有
A.含有大量Ba2+的溶液中:HCO3-、Fe3+、Ag+、SO42-、SCN-
B.滴加无色酚酞试液后仍无色的溶液中:Na+、CO32-、K+、ClO-、AlO2-
C.由水电离的c(OH-)=10-14mol·L-1 的溶液中:CH3COO-、C6H5O-、Na+、K+
D.加入铝粉后产生氢气的溶液中:NH4+、Na+、NO3-、Cl-、HS-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com