
题目列表(包括答案和解析)
16.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是
A K+一定存在 B 100mL溶液中含0.01mol CO32-
C Cl-一定存在 D Ba2+一定不存在,Mg2+可能存在
15、下列反应的离子方程式书写正确的是
A、碳酸氢钙溶液中加入过量的NaOH溶液:
Ca2++HCO3-+OH-=CaCO3↓+H2O
B、溶液中NH4HSO3与NaOH等物质的量混合:
NH4++HSO3-+2OH-=SO32-+NH3·H2O+H2O
C.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 2Fe2+ + 2H+ + H2O2 =2 Fe3+ + 2H2O
D、硫化钠溶于水中:S2-+H2O=HS-+OH-
14.水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O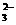 +O2+xOH-
+O2+xOH- Fe3O4+S4O +2H2O,下列说法中,正确的是
+2H2O,下列说法中,正确的是
A.每生成1mol Fe3O4,反应转移的电子总数为4mol
B.Fe2+和S2O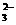 都是还原剂
都是还原剂
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol
D.x=2
13、质量分数为a%,物质的量浓度为c mol/L 的KOH溶液,蒸发溶剂,恢复到原来温度,若质量分数变为2a%,则物质的量浓度变为
A.等于2c mol/L B.大于2c mol/L
C.小于2c mol/L D.在c mol/L∽2c mol/L之间
12、下列各组离子在相应的条件下可以大量共存的是
A.在碱性溶液中:CO32-、K+、C1-、Na+
B.与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+、Na+、SO42-
C.在c(H+)/c(OH-)==1×1012的溶液中:NH4+、Ca2+、C1-、K+
D.在中性溶液中:Fe3+、S2-、NO3-、A13+
11、设NA代表阿伏加德罗常数,下列说法正确的是
A.用惰性电极电解500mL饱和食盐水时,若溶液的pH值变为14时,则电极上转移的电子数目为NA
B.将162.5g FeCl3转化为氢氧化铁胶体后,氢氧化铁胶体粒子数等于6.02×1023
C.标准状况下,22.4L甲烷和乙炔混合物所含的分子数为NA
D.46g 二氧化氮和46g四氧化二氮含有的原子数均为3NA
10.甲、乙、丙三种物质(均不含结晶水)的溶解度曲线如图所示,以下说法不正确的是
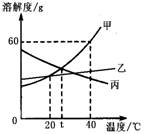 A.40℃时,100g水中最多溶解甲60g
A.40℃时,100g水中最多溶解甲60g
B.t℃时,甲与丙的溶解度相等
C.分别将40℃时甲、丙的饱和溶液降温至t℃,
所得两溶液中溶质的质量分数相等
D.甲中混有少量乙,可用降温结晶法分离提纯甲
9.在饱和NaOH溶液中加入一定量Na2O2,充分反应后恢复到原温度,下列说法正确的是( )
A.有晶体析出,原溶液质量不变 B.有晶体析出,原溶剂质量不变
C.溶液仍为饱和溶液,浓度增大 D.溶液仍为饱和溶液,浓度不变
8.下列说法正确的是( )
A.用25ml量筒量取12.3ml盐酸;用托盘天平称取8.75g食盐
B.用pH试纸测得某氯水的pH为2;用标准NaOH溶液滴定未知浓度的盐酸,用去NaOH溶液23.10ml
C.将质量分数为5%和25%的氨水等体积混合后,所得溶液中溶质的质量分数大于15%
D.浓硝酸必须保存在棕色玻璃瓶中;用镊子取出白磷并置于水中切割
7.先将甲物质放于托盘天平右盘进行称量,再将乙物质放在左盘进行称量,若两次都使用了游码,且砝码和游码的读数均相等,甲、乙两物质的质量( )
A.小于 B.等于 C.大于 D.不能确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com