
题目列表(包括答案和解析)
1.合理利用燃料减少污染符合“绿色奥运”理念,下列关于燃料的说法正确的是[ ]
A.“可燃冰”是将水变为油的新型燃料
B.氢气是具有热值高、无污染等优点的燃料
C.乙醇是比汽油更环保,不可再生的燃料
D.石油和煤是工厂经常使用可再生的化石燃料
23.(8分)现有一种碱金属的碳酸盐(M2CO3)和碳酸氢钠组成的混合物,取其1.896g加热至质量不再变化,把放出的气体通入足量的澄清石灰水中,得到白色沉淀0.800g。将加热后残留的固体与足量稀硫酸充分反应,生成的气体经充分干燥后通过足量的过氧化钠粉末(反应为:2Na2O2+2CO2=2Na2CO3+O2),结果过氧化钠粉末增重0.336g。
⑴通过计算确定M2CO3的M为何种元素。
⑵有同学提出,通过简单的定性实验,也可以确定该样品中的M为何种碱金属元素。你认为该实验方案是什么?
2007-2008学年第一学期高三期中化学试题
22. (8分)在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如右图所示。
(8分)在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如右图所示。
⑴t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为_____________________________________________。
⑵该石灰乳中含有Ca(OH)2的物质的量是_______ mol。
⑶ 据分析,生成Ca(C1O3)2的反应是由温度升高引起的,通入氯气的速度不同,C1O-和C1O3-的比例也不同。
若在原石灰乳中通入氯气的速度加快,则反应后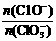 2(填“>”、“<”或“=”);
2(填“>”、“<”或“=”);
若 ,则n(C1-)= mol(用含a的代数式来表示)。
,则n(C1-)= mol(用含a的代数式来表示)。
21. (12分)2007年诺贝尔化学奖授予德国科学家格哈德·埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献。
(12分)2007年诺贝尔化学奖授予德国科学家格哈德·埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献。
⑴某校化学研究性学习小组的同学在技术人员的指导下,按下列流程探究不同催化剂对NH3还原NO反应的催化性能。

若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通过滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。为比较不同催化剂的催化性能,需要测量并记录的数据是 。
⑵在汽车的排气管上安装“催化转化器”(用铂、钯合金作催化剂),它的作用是使CO、NO反应生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧。
①写出CO与NO反应的化学方程式: ,该反应作氧化剂的物质是_________。
②用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g); ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g); ΔH2
若1mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则ΔH2= 。
⑶①有人认为:该研究可以使氨的合成反应,在铁催化剂表面进行时的效率大大提高,从而使原料的转化率大大提高。请你应用化学基本理论对此观点进行评价: 。
②合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3,当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高,以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:2 Fe2O3十C
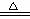 4FeO十CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为
g。
4FeO十CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为
g。
20.(12分)下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。

已知:E为红色固体,K为浅绿色溶液;反应②是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G分子构型为三角锥形,化合物M由两种元素组成,分子内共有58个电子。
⑴化合物A中含有的两种元素是 。
⑵F的化学式 ;G的水溶液中,最多的阳离子是 。
⑶写出K与H反应的离子方程式: ;
G与H反应的化学方程式: 。
⑷在实验室中,向饱和H水溶液中加入CaCO3粉末,充分反应后过滤,可制得浓度较大的P的水溶液。使用化学平衡移动原理加以解释
。
19.(10分)在一固定体积的密闭容器中,在850℃时发生如下反应:
CO(g)+H2O(g) CO2(g)+H2(g); △H=-41.2kJ/mol。容器内各物质的浓度(mol/L)变化如下(在850℃其化学平衡常数K=1.0)。
CO2(g)+H2(g); △H=-41.2kJ/mol。容器内各物质的浓度(mol/L)变化如下(在850℃其化学平衡常数K=1.0)。
|
时间/min |
CO |
H2O |
CO2 |
H2 |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
c1 |
c2 |
c3 |
c3 |
|
4 |
c1 |
c2 |
c3 |
c3 |
⑴下列可以作为判断该反应已经达到化学平衡状态依据的是 。
a.容器内压强不变 b.v正(H2) = v逆(CO)
c.混合气体中CO2的浓度不变 d.c(CO2) = c(CO)
⑵若在850℃时向反应容器中充入H2O(g),K值 (填“增大”、“减小”或“不变”,下同);若升高反应体系的温度,K值 。
⑶上表中:c1 = mol/L,H2O (g)的转化率为 。
18.(12分)测定含I-浓度很小的碘化物溶液时,利用振荡反应进行化学放大,可以准确求出原溶液中I-的浓度。主要步骤如是:
①取100mL样品溶液,用单质溴将样品中的I-氧化成IO ,将过量的溴除去。
,将过量的溴除去。
②再加入过量的KI,并用硫酸酸化,使IO 完全转化成I2。
完全转化成I2。
③将②中生成的碘完全萃取后,用肼将其还原成I-。
④将生成的I-萃取到水层后,用步骤①的方法再处理转化为IO 。
。
⑤将④得到的溶液加入适量的KI溶液,并用硫酸酸化,使IO 完全转化成I2。
完全转化成I2。
⑥将⑤得到的溶液完全转入250mL容量瓶,并加水稀释至刻度。
⑦分别取⑥得到的溶液25.00mL于锥形瓶中,加入指示剂,用0.1010mol/L 的Na2S2O3标准溶液滴定(2Na2S2O3+I2=Na2S4O6+2NaI)。
⑧重复操作⑦两次。
根据上述步骤回答下列问题:
⑴在操作①中,除去过量溴单质的方法是 。
⑵请写出操作②中发生的反应的离子方程式 。
⑶在萃取操作中,使用的玻璃仪器有 。步骤⑦使用的指示剂是 ;判断滴定达到终点的现象为 。
⑷下表是该实验的记录结果:
|
滴定 次数 |
待测溶液的体积 |
标准溶液的体积 |
|
|
滴定前刻度/mL |
滴定后刻度/mL |
||
|
1 |
25.00 |
1.02 |
21.05 |
|
2 |
25.00 |
2.00 |
21.99 |
|
3 |
25.00 |
0.11 |
20.09 |
原溶液中I-的物质的量浓度为 。
17.(10分)某化学兴趣小组在做实验时,将AgNO3溶液和KI溶液混合,发现有黄色沉淀生成,振荡后迅速消失。大家经查阅资料后,发现可能的原因是发生了下列反应:AgI+I- [AgI2]-。
[AgI2]-。
⑴甲同学设计了两个简单的实验方案来进行验证,请你协助他完成实验。
实验1:向浓KI溶液中滴加AgNO3溶液,现象为 。
实验2:向AgNO3溶液中滴加稀KI溶液,有黄色沉淀生成;再
。
⑵乙同学在实验所得的溶液中滴加硝酸溶液,结果又出现了沉淀。请解释出现沉淀的原因 。
⑶丙同学在实验所得的溶液中滴加氯水也可以看到沉淀,但由于溶液为黄色,分不清沉淀的颜色。大家通过查阅数据,分析认为产生的沉淀不可能是AgCl,所查阅的数据是 ;请设计简单的实验说明不会产生AgCl沉淀: 。
16.世界上60%的镁是从海水中提取的,其主要步骤如下:
①把贝壳制成石灰乳;②在海水中加入石灰乳,过滤,洗涤沉淀物;③将沉淀物与盐酸反应,结晶、过滤;④在氯化氢热气流中干燥晶体;⑤电解上述晶体的熔融物。
下列说法正确的是
A.镁元素在元素周期表中位于第三周期、ⅡA族
B.向洗涤液中滴加碳酸钠溶液可检验沉淀是否洗涤干净
C.在氯化氢热气流中干燥晶体的目的是加快干燥速度
D.步骤⑤也可以采用电解该晶体水溶液的方法
第二卷(非选择题 共72分)
15.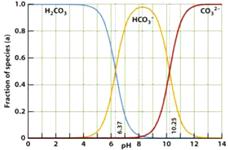 下图是一水溶液在pH从0至14的范围内,H2CO3、HCO
下图是一水溶液在pH从0至14的范围内,H2CO3、HCO 、CO
、CO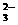 三种成分平衡时的组成百分率,下列叙述正确的是
三种成分平衡时的组成百分率,下列叙述正确的是
A.此图是1.0mol/L碳酸钠溶液滴定1.0 mol/L
HCl溶液的滴定曲线
B.在pH为6.37及10.25时,溶液中
c(H2CO3)= c(HCO )= c(CO
)= c(CO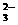 )
)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO 的形式存在
的形式存在
D.若用CO2和NaOH反应制取Na2CO3,溶液的pH必须控制在12以上
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com